课外活动小组为测定某未知稀硫酸的质量分数,进行了下面实验:
①取10g稀硫酸于烧杯中,逐滴滴加BaCl2溶液,至不再产生白色沉淀止,经过滤、洗涤,干燥后,称得沉淀物的质量为4.71g
②为保障测定结果的精确性,按实验①操作又连续进行了四次相同的实验。几次实验所得数据见下表:
第一次 |
第二次 |
第三次 |
第四次 |
第五次 |
|
固体质量/g |
4.71 |
4.63 |
4.64 |
4.66 |
4.66 |
分析实验与表中数据后,回答:
(1)第一次实验测得数据明显偏高,可能的原因是 ;
(2)五次测定结果的平均值是 ;
(3)请利用(2)中数据计算:未知稀硫酸的质量分数是 。(不要求计算过程,计算结果精确到0.01)
镁元素广泛应用于火箭、导弹和飞机制造业,被称为“国防元素”。如图1所示为制取单质镁的转化过程,试回答下列问题:
如图转化过程中发生的化学反应主要有:

MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2
Mg(OH)2+2HCl═MgCl2+2H2O,MgCl2 Mg+Cl2↑
(1)在过程①中,所加石灰乳的主要成分是 (填写化学式)。
(2)过程②所发生的反应属于 (填“化合”“分解”“置换”或“复分解”)反应。
(3)下列有关过程③中能量转化的说法,正确的是 (填选项序号)。
A.电能转化为化学能 B.化学能转化为电能 C.潮汐能转化为化学能
(4)海水或卤水中本来就含有氯化镁,还需要过程①②的原因是 (选项序号)。
A.将氯化镁富集提纯 B.生成更多氯化镁 C.使石灰乳和稀盐酸反应
(5)某化学兴趣小组欲测定某氯化镁样品中MgCl2的含量(杂质为NaCl),称取10g该样品将其置于干净的烧杯中,加入适量水,使固体样品完全溶解。向所得溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成沉淀的质量与滴入NaOH溶液的质量关系如图所示。试回答下列问题:

①当滴入NaOH溶液120g时(即图中B点),烧杯中溶液里含有的溶质为 (写化学式)。
②当滴入10%的NaOH溶液80g时(即图中A点),恰好完全反应,试通过计算,求10g此氯化镁样品中MgCl2的质量。(计算结果精确至0.1g)
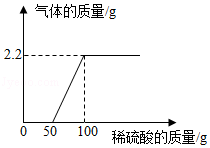
某校化学兴趣小组同学,将一定量的稀硫酸滴入9.3g氢氧化钠和碳酸钠的固体混合物中,产生气体质量与滴入稀硫酸的质量关系如图所示。试计算:
(1)产生二氧化碳气体的质量为 ;
(2)混合物与稀硫酸恰好完全反应时所得溶液中溶质的质量是多少?
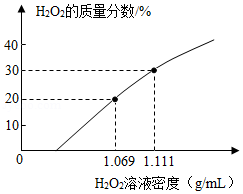
在新冠肺炎的疫情防控中,过氧化氢(H2O2)广泛用于环境消毒,在放置过程中会缓慢分解。某单位有一桶未曾使用过的久置的H2O2溶液,观测得其溶液密度为1.069g/mL,该温度下溶液的密度和溶质质量分数的对应关系如图。桶上标签提供的信息:①H2O2的质量分数为30%;②内装溶液质量50kg,完成下列问题:
(1)该久置的H2O2溶液的溶质质量分数为 。
(2)若用此久置的H2O2溶液来配制质量分数为3%的环境消毒液200kg,需用这种H2O2溶液 kg。
(3)若这桶H2O2溶液放置至完全分解,桶中剩下的液体质量是多少?(假设液体不挥发,通过计算回答,结果精确到0.1)
铜锌合金又叫黄铜,外观酷似黄金,极易以假乱真。某化学兴趣小组用图I所示装置测定黄铜中锌的含量。将足量的稀硫酸全部加入锥形瓶中,充分反应后天平示数的变化如图Ⅱ所示。请计算:

(1)生成氢气 g。
(2)黄铜样品中锌的质量分数。(写出计算过程)
硼及其化合物在现代工农业、医学、国防中有着重要的应用价值。利用硼镁矿可制备硼,工艺流程如图所示。请回答下列问题:

(1)B2O3中B元素的化合价为 。
(2)为加快硼镁矿石与浓NaOH溶液的反应速率,可采取的措施是 ;回收副产物Mg(OH)2可制得流程 的反应物。
(3)H3BO3加热分解只生成两种氧化物,流程②的化学反应方程式为 。
(4)根据流程③的化学反应方程式:B2O3+3Mg 2B+3MgO,理论上制备1.1吨的硼,需消耗镁多少吨写出计算过程)?
小科为测定某石灰石样品(主要成分为碳酸钙,其它成分不与稀盐酸反应)中碳酸钙的含量,利用气密性良好的图甲装置进行实验:①称取石灰石样品6克,加入锥形瓶中,塞紧瓶塞,从左侧持续缓慢鼓入空气;②一段时间后打开分液漏斗活塞,注入足量的稀盐酸,开始计时;③待装置D总质量不再增加时停止鼓入空气。实验过程中测得装置D增加的质量随时间变化图象如图乙。(碱石灰能吸收二氧化碳和水) 
(1)根据图乙,运用化学方程式计算该石灰石样品中碳酸钙的质量分数。(计算结果精确到0.1%)
(2)下列情况中,会导致测得的碳酸钙质量分数偏大的是 。
①去掉装置A,将空气直接鼓入装置B
②去掉装置C,将B与D装置直接相连
③当气泡停止产生时立即停止鼓入空气
工业盐酸中通常含少量FeCl3而呈黄色。小亮为测定某工业盐酸中HCl的含量进行如下实验,取某工业盐酸50g,滴加溶质质量分数为20%的NaOH溶液,反应过程中,当加入的NaOH溶液质量至以下数值时,对充分反应后所得溶液的质量进行了测定,部分数据如下表,请根据表格和图象完成下列问题:
加入NaOH溶液的质量/g |
25 |
50 |
75 |
100 |
所得溶液的质量/g |
75 |
100 |
125 |
m |
(1)开始没有产生沉淀的原因是 。
(2)求该工业盐酸中HCl的质量分数(写出计算过程)。
(3)m= (结果保留两位小数)。

在进行“实验活动1 氧气的实验室制取与性质”前,化学老师预计本次实验共需要收集45瓶氧气,通过计算得知:这些氧气的总质量约是16g。请计算要想制取足够的氧气,至少需要准备多少克高锰酸钾?
实验室有一份在空气中潮解变质的氢氧化钠样品,质量为1.5g某实验小组将这份样品完全溶解,配成50g溶液,然后缓慢滴入7.3%的稀盐酸,同时进行搅拌,使二氧化碳全部逸出。滴加过程中,多次测得溶液pH和溶液总质量,部分数据如下表所示:
| 测量次数 |
第1次 |
第6次 |
第16次 |
第21次 |
第26次 |
| 滴加的盐酸总质量/g |
0 |
5 |
15 |
20 |
25 |
| 溶液总质量/g |
50 |
55 |
m |
69.78 |
74.78 |
| 溶液pH |
12.4 |
12.1 |
7.0 |
2.2 |
2.1 |
请分析计算:
(1)第 次测量时,溶液中只有一种溶质。
(2)表中m= 。
(3)样品中碳酸钠的质量分数。(计算结果精确到0.1%)
(4)1.5g样品中氢氧化钠固体的质量。
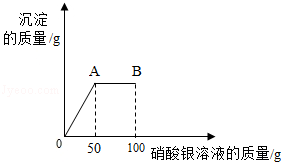
将1.17 g氯化钠固体放入烧杯中,加入51.7g水充分溶解后得到常温下氯化钠的不饱和溶液,再向所得溶液中逐滴滴入100 g一定溶质质量分数的硝酸银溶液。实验过程中生成沉淀的质量与滴入硝酸银溶液的质量关系如图所示:
(1)B点时,溶液中所含硝酸银的质量为 。
(2)A点时,所得溶液中溶质质量分数为多少?(计算结果精确到0.1%)
小苏打的主要成分是碳酸氢钠,其中往往含有少量的氯化钠,化学兴趣小组的同学要通过实验来测定某品牌小苏打样品中碳酸氢钠的质量分数。
(1)准确称取9.0g小苏打样品放入烧杯中,逐滴加入质量分数为5%的稀盐酸至恰好不再产生气泡为止,共消耗稀盐酸73.0g,烧杯中没有残留不溶物。计算样品中碳酸氢钠的质量分数。(写出计算过程)
(2)请你设计一个与上述实验原理和操作方法均不相同的实验,测定小苏打样品中碳酸氢钠的质量分数 。
南通滨临长江,将长江水净化处理可成为居民生活用水。
(1)水净化时先加入絮凝剂,沉降过滤后,通过活性炭。活性炭的作用是 。
(2)将硬水通过如图所示的阳离子交换柱后可变成软水(图中阴离子未画出),交换后的水仍然呈电中性。
①一个Ca2+可以交换出 个Na+。
②阳离子交换柱长时间使用后,Na+变少,失去硬水软化功能而失效。利用生活中常见物质检验阳离子交换柱已失效的方法是 。
(3)二氧化氯(ClO2)可用于饮用水的杀菌消毒。取100mL经ClO2消毒后的饮用水于锥形瓶中,调节溶液至弱碱性,加入足量KI充分反应,测得生成I2的质量为0.0254mg。上述过程中发生的反应为2ClO2+2KI═2KClO2+I2,其他物质不参与反应。计算该饮用水中ClO2的残留量(以mg/L计),在答题卡上写出计算过程。

实验室里有一瓶氢氧化钙粉末由于较长时间敞口放置,已部分变质为碳酸钙。某课外兴趣小组为测定该瓶粉末中碳酸钙的质量分数,进行实验操作、数据收集和计算。
(1)配制稀盐酸:配制500克7.3%的稀盐酸,需要36.5%的浓盐酸 克。
(2)抽样测定:将瓶中粉末搅拌均匀后称取20克样品放入烧杯并置于电子秤上,再加入足量稀盐酸充分反应,总质量与反应时间的关系如下表所示:
| 反应时间/秒 |
0 |
10 |
20 |
30 |
40 |
| 总质量/克 |
310.0 |
309.6 |
308.6 |
307.8 |
307.8 |
完全反应后,生成的CO 2气体的质量为 克
(3)计算出该样品中CaCO 3的质量分数(要有计算过程)。
(4)经过分析讨论,同学们觉得这样测得的结果有可能偏大,原因是 (指出一点即可)