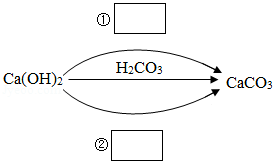
(1)化合物可以分为酸、碱、盐及氧化物。在下图中填写不同类别的物质(填化学式)实现Ca(OH) 2一步转化为CaCO 3。
(2)某Ca(OH) 2样品部分变质为CaCO 3(假设其成分均匀)。化学兴趣小组按以下步骤测定该样品中Ca(OH) 2的质量分数。
①配制盐酸:配制500g质量分数为6%的盐酸,需要质量分数为30%的盐酸 g。
②实验测定:
称取10.0g样品置于烧杯中,加入足量稀盐酸充分反应,烧杯总质量与反应时间的关系如下表所示:
| 反应时间/min |
0 |
t 1 |
t 2 |
t 3 |
| 烧杯总质量/g |
280.0 |
278.9 |
277.8 |
277.8 |
完全反应后,生成的CO 2气体的质量为 g。
③数据处理:计算该样品中Ca(OH) 2的质量分数(根据化学方程式的计算写出完整的计算步骤)。
室温为25℃时,某小组用无水氯化铜粉末制备氯化铜大晶体,制备过程如下:
步骤I:查阅资料,得到氯化铜溶解度数据如下
| 温度(℃) |
0 |
20 |
25 |
40 |
50 |
60 |
80 |
| 溶解度(g) |
69.2 |
74.5 |
76.4 |
81.8 |
85.5 |
89.4 |
98.0 |
步骤Ⅱ:配制少量CuCl 2热饱和溶液,冷却结晶,得到晶种。
步骤Ⅲ:把晶种悬挂在新配制的CuCl 2热饱和溶液中,室温下静置数天,形成大晶体。
步骤Ⅳ:取出大晶体,处理剩余的溶液(母液)。
根据以上信息,回答下列问题:
(1)用20mL蒸馏水(密度约为1g/mL)配制50℃的氯化铜饱和溶液。
①计算需称取CuCl 2的质量是 g。
②将称取的CuCl 2固体和20mL水倒入烧杯中, (填操作名称),直至固体完全溶解。
(2)母液中Cu 2+属于重金属离子,随意排放将导致环境污染。下列方法可用于母液处理的是 。
A.收集母液于敞口容器中,用报纸包住容器口,待水分自然蒸干后保存所得固体
B.向母液中加入适量AgNO 3,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
C.向母液中加入适量NaOH,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
(3)若用铁粉置换出母液中的铜,100g母液需要铁粉的质量至少是 g(只列计算式,已知CuCl 2的相对分子质量为135)。
某化学兴趣小组取部分变质的Ca(OH)2(含杂质CaCO3)样品4.0g投入200.0g水中,充分搅拌,通入足量CO2,溶液质量与反应的CO2质量的关系如图所示.则:
(l)Ca(OH)2全部转化为CaCO3时消耗的CO2质量为 g;
(2)4.0g样品中杂质CaCO3的质量为多少?(写出计算过程)
(3)通入m3gCO2时,溶液中生成物的溶质的质量分数为 (精确到0.1%).若所取样品中的Ca(OH)2没有完全溶于水,对最后的计算结果 (填“有”、“没有”)影响.原因是 .

我国矿物种类齐全,储量丰富。工业上从从含有金属元素的矿石中提炼金属。其中赤铁矿是炼铁的主要原料。请回答下列问题:
I.铁制品广泛应用于生产、生活中。
(1)下列不属于铁合金的是 (选填字母)。
A.Fe(OH)3 B.生铁 C.不锈钢
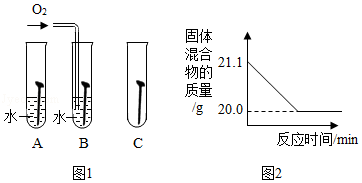
(2)铁钉生锈,属于 变化(选填“物理”“化学”):如图1是探究铁钉在不同条件下发生生锈的实验,其中铁锈蚀最快的是 (选填字母)。
II.赤铁矿(主要成分为Fe2O3)可用于生产催化剂。
(3)在Fe2O3中,氧元素的质量分数为 。
(4)赤铁矿经提纯后得到的纯净Fe2O3可用于生产某种工业催化剂(主要成分为FeO和Fe2O3),其反应原理为:2 Fe2O3+C 4FeO+CO2↑.现将焦炭和过量的Fe2O3混合均匀,按上述原理充分反应,如图2为固体混合物的质量随反应时间的变化曲线。
①由图可知:生成CO2气体的质量为 g。
②计算反应后固体混合物中FeO的质量分数(请根据化学方程式写出完整的计算步骤)。
某同学在实验室用6.5g粗锌(假设杂质不参与反应)和稀盐酸制取H2。
(1)配制100g 10%稀盐酸需要37%浓盐酸(密度1.19g/cm3)的体积为 mL(结果保留小数点后一位)。除了胶头滴管、烧杯外还需要的玻璃仪器是 、 。
(2)6.5g粗锌完全反应共产生H2的质量为0.16g,则该粗锌中锌的质量分数为 。
(3)验证后用装满水的10mL量筒代替小试管收集H2,装置如图所示。
①10mL量筒的最大刻度靠近 端。(填写“M”或“N”)
②当10mL量筒中的水全部被排尽后,实际收集到的H2体积V 10.0mL.(填写“>”、“=”或“<”)

过氧化钙(CaO2)是一种环境友好的化工原料,工农业生产中用作漂白剂、种子消毒剂以及鱼类运输时的制氧剂等。过氧化钙与水反应方程式为:2CaO2+2H2O═2Ca(OH)2+O2↑。
(1)若用150g某过氧化钙工业样品可制得氧气32g,请计算该过氧化钙样品的纯度(样品中CaO2的质量分数)是多少?
(2)往150g上述过氧化钙工业样品中逐渐加入水至过量,在如图中画出产生氧气的曲线图。
(3)下表为市面上某种过氧化钙和过氧化钠(化学式为Na2O2,化学性质与CaO2类似)样品的一些数据:
物质 |
相对分子质量 |
纯度 |
价格(元/kg) |
Na2O2 |
78 |
98% |
25 |
CaO2 |
72 |
94% |
24 |
用3000元购买样品制氧气,请通过计算说明购买哪种产品可制得更多的O2(已知用3000元购买过氧化钙样品可制得26.1kg O2)?

(1)化学兴趣小组的同学欲除去某FeCl2溶液中混有的CuCl2杂质,实验操作步骤如下:
①在混合溶液中加入过量的 粉(只有一个正确选项,选填字母),搅拌,使其充分反应:
A.铁 B.铜 C.银
②过滤,得到FeCl2溶液和金属混合物.
(2)该小组同学欲继续探究上述②得到的金属混合物中Cu的质量分数,将该金属混合物洗涤、干燥,称得其质量为28.0g.向此金属混合物中逐滴滴加稀盐酸,产生氢气的质量与加入稀盐酸溶液的质量关系如图所示,完成下列问题:
①计算该金属混合物中Cu的质量分数.(请根据化学方程式写出完整的计算步骤)
②该实验中,有同学认为还可以通过测定其他数据来计算Cu的质量分数,实验时他需要测定的实验数据应是 .

某化学兴趣小组同学为回收一块质量为40g的铜锌合金中的铜,将该合金放入烧杯中,逐渐加入稀硫酸至不再产生气泡时,恰好用去稀硫酸100g,烧杯内剩余固体27g。
请完成下列分析及计算。
(1)40g铜锌合金中锌的质量是 g。
(2)计算所用稀硫酸中溶质的质量分数。
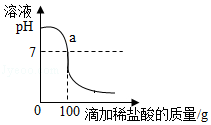
将含有NaCl杂质的某烧碱样品10g完全溶于90g水中,再向所得溶液中慢慢滴入溶质质量分数为7.3%的稀盐酸.在实验过程中,溶液的pH与滴入稀盐酸的质量关系如图所示.
(1)求l0g该样品中氢氧化钠的质量.
(2)求a点时,溶液中溶质的质量分数(计箅结果精确到0.1%)
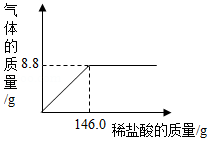
为了节约林木资源,近几年兴起了一种含碳酸钙的“石头纸”,这种“石头纸”是用沿海水产养殖中大量废弃贝壳制得的,为测定其中碳酸钙(杂质不溶于水也不与水反应)的含量。某校化学兴趣小组的同学进行了如下实验(水和氯化氢的挥发忽略不计);取25.0g样品粉碎放入烧杯中,加入一定质量分数的稀盐酸,所加稀盐酸的质量与生成气体的所量关系如图所示:
(1)计算“石头纸”中碳酸钙的质量分数。
(2)完全反应后烧杯内溶液的溶质的质量分数是多少?(结果精确到0.1%)
实验室固体氢氧化钠敞口放置在空气中容易变质而失效,现称取该久置于空气中的烧碱样品10.6g完全溶于蒸馏水中配成100g溶液,向其中滴加质量分数为3.7%的氢氧化钙溶液,产生沉淀与所加氢氧化钙溶液的质量关系如图所示。请通过计算回答:
(1)该烧碱样品变质的程度为 (填"部分变质"或"全部变质")。
(2)m= g。
(3)当沉淀刚好达到最大质量时,溶液中溶质质量分数为多少?(写出计算过程,计算结果精确到0.01%)

根据化学方程式进行计算。二氧化碳通入足量的石灰水生成沉淀10g,与石灰水中的氢氧化钙反应的二氧化碳是多少g?
改革开放以来,我国钢铁工业飞速发展,近年来钢铁产量已稳居世界首位。某钢铁厂采用赤铁矿(主要成分为Fe 2O 3)炼铁,反应原理为Fe 2O 3+3CO 2Fe+3CO 2.若该厂日产含铁1.4×10 4t的生铁,至少需要含Fe 2O 3 80%的赤铁矿的质量是多少?(要求写出计算过程)
一种新型"人造树叶"可吸收二氧化碳并转化为乙醇(C 2H 5OH)燃料,化学方程式为:2CO 2+3H 2O C 2H 5OH+3O 2.研究显示,一升"人造树叶"每天可从空气中吸收968g CO 2
(1)一升"人造树叶"工作一天可得到乙醇的质量是多少?
(2)若每天一棵树平均可吸收48.4g CO 2,则一升"人造树叶"吸收的CO 2相当于 棵树吸收的CO 2。