我国著名化工专家侯德榜创立了"候氏制碱法",促进了我国民族工业的发展。其生产原理是在氯化钠饱和溶液中通入氨气,再通入二氧化碳,使溶解度较小的碳酸氢钠从溶液中以沉淀的形式析出:
NaCl+NH 3+CO 2+H 2O═NH 4Cl+NaHCO 3↓
过滤出碳酸钠晶体,再受热分解得到产品:2NaHCO 3  Na 2CO 3+H 2O+CO 2↑
Na 2CO 3+H 2O+CO 2↑
(1)"侯氏制碱法"制得的"碱"是 (写化学式);
(2)根据化学方程式计算,5.85吨NaCl可制得8.4吨NaHCO 3,实际上从反应后的混合物溶液中析出NaHCO 3晶体的质量 8.4吨;(选填"大于"、"等于"或"小于")
(3)与"侯氏制碱法"不同的是,比利时科学家苏尔维在制碱过程中,向滤出NaHCO 3晶体后的混合溶液中加熟石灰以回收氨气:2NH 4Cl+Ca(OH) 2  CaCl 2+2NH 3↑+2H 2O
CaCl 2+2NH 3↑+2H 2O
请计算:NH 4Cl质量分数为20%的混合溶液5.35吨,完全反应后理论上可获得NH 3多少吨?
某Na 2CO 3样品中混有一定量的Na 2SO 4,小明想测定样品中Na 2CO 3的质量分数,取该样品20克放入烧杯,加入100克水使样品全部溶解,再向烧杯中滴加稀硫酸,当滴加的稀硫酸质量为50克时,恰好完全反应,称得烧杯中溶液的质量是165.6克.
请通过计算回答:
(1)滴加的稀硫酸中溶质的质量分数.
(2)该样品中Na 2CO 3的质量分数.
化学兴趣小组对某工业废水(溶质为HCl、NaCl)中的HCl含量进行测定,甲、乙两位同学各提供不同的测定方法:
(1)甲同学:酸碱中和法
取50g废水于烧杯中,逐滴滴入溶质质量分数为10%的NaOH溶液,反应过程中溶液的pH变化如图所示,求废水中HCl的质量分数(写出详细的计算过程)。
(2)乙同学:沉淀法
改用AgNO 3溶液代替NaOH溶液,根据生成沉淀的质量来确定废水中HCl的质量分数,你认为结果将 (填"偏高""偏小"或"无影响")。

绿矾(FeSO4•7H2O)是硫酸法生产太白粉的主要副产物,可用于制备Fe2O3,复印用Fe3O4粉、还原铁粉等,开发利用绿矾工艺是一项十分有意义的工作。某研究性小组展开了系列研究。
Ⅰ制备Fe2O3
【资料一】
(1)无水硫酸铜遇水变成蓝色的硫酸铜晶体。
(2)绿矾(FeSO4•7H2O)高温分解产生一种金属氧化物和几种气态非金属氧化物。
(3)SO2是无色有窒息性臭味的有毒气体,能使品红溶液褪色。
甲同学用如下装置制备Fe2O3并验证绿矾受热分解的其他产物;

实验过程中发现:A中有 色固体生成,B中无水硫酸铜变蓝,C中U形管内有无色晶体(SO3)析出,D中品红溶液褪色,装置E的作用是 ,绿矾高温分解的化学方程式为 。
Ⅱ制备Fe3O4
乙同学模拟生产复印用Fe3O4粉的实验流程如下:

【资料二】Fe(OH)2是一种白色难溶于水的固体,在空气中易被氧化。
FeSO4溶液中加入NaOH溶液,反应的化学方程式依次为① ,②4Fe(OH)2+O2+2H2O═4Fe(OH)3.由沉淀a获得Fe3O4的化学方程式为:Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O
若制取Fe(OH)2,采取的实验操作是:向盛有5mL新制FeSO4溶液的试管中加入10滴植物油,然后用胶头滴管加煮沸的NaOH溶液(驱赶O2),胶头滴管的正确使用方法是 (填字母)。

Ⅲ制备还原铁粉
制备还原铁粉的工业流程如下:

(1)操作1的名称是 ,NH4HCO3和FeSO4溶液反应的化学方程式为 。
(2)若将14.06g粗还原铁粉(假设粗还原铁粉中杂质仅含少量FexC)在氧气流中完全反应,得到0.22gCO2,将相同质量的粗还原铁粉与足量稀硫酸反应,得到0.48gH2(FexC与稀硫酸反应不产生H2)。试通过计算确定FexC的化学式(请写出计算过程) 。
(3)粗还原铁粉经加工处理后变成纯还原铁粉,纯还原铁粉和水蒸气在高温条件下也可制得四氧化三铁,同时生成一种气体。其装置如图所示:

SAP材料吸水性强,湿润的SAP材料能为该反应持续提供水蒸气。实验开始一段时间后,观察到在肥皂液中有大量的气泡产生,此气泡用火柴即能点燃,同时有肥皂泡飘到空中。生成的气体是 ,干燥的SAP材料作用是 。
为测定某市售碳酸钙药品中碳酸钙的质量分数(杂质为SiO2,与稀盐酸不反应),某同学的方法是:将样品与稀盐酸反应,测定反应后生成的CO2质量,再根据CO2的质量求出样品中碳酸钙的质量,从而计算出样品中碳酸钙的质量分数.为测定生成CO2的质量,他设计了如下实验方案(已知:无水氯化钙是常见的干燥剂):
(1)按图组装好装置,检查装置气密性后,在分液漏斗中加入过量稀盐酸,并在干燥管中加入适量无水氯化钙样品,称得装置和药品的总质量为564.57g;
(2)在广口瓶中加入碳酸钙样品,称得装置和药品的总质量为574.57g;
(3)旋紧橡皮塞,打开分液漏斗旋塞,向广口瓶中滴加稀盐酸,使样品与稀盐酸完全反应;
(4)反应结束后,称得装置及装置内所有物质的总质量为570.57g
请根据上述实验回答下列问题:
(1)该方案测得样品中碳酸钙的质量分数是多少(写出解题过程,计算结果精确到0.1%)?
(2)该实验中用稀盐酸与碳酸钙样品反应,而不用浓盐酸与碳酸钙样品反应,其原因是 .若实验中不用无水氯化钙干燥,则测得样品中碳酸钙的质量分数与上述实验计算结果相比 (选填“偏小”或“不变”或“偏大”).

在催化剂的作用下,用O 2将HCl转化为Cl 2,可提高效益,减少污染.
(1)写出反应Ⅰ的化学方程式 ;
(2)反应Ⅱ所属基本反应类型为 ;
(3)钠在氯气中燃烧生成氯化钠,若4.6g钠完全转化为氯化钠,至少需要氯气的质量是多少?

天然水净化为自来水的主要流程如下:
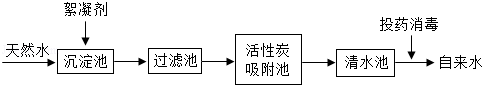
(1)下列说法不正确的是(填字母) .
A.过滤池可以除去难溶性杂质
B.活性炭吸附池可以除去水中的色素和臭味
C.清水池中一定是软水
(2)明矾[KAl(SO 4) m•12H 2O]能作絮凝剂,是因为明矾溶于水后生成具有吸附作用的胶状物氢氧化铝.m= ,氢氧化铝的化学式为 .
(3)目前不少自来水用液氯(Cl 2)作为消毒剂,液氯注入水后发生反应的示意图:

其中"  "、"○"、"●"代表不同原子,产物D为次氯酸(HClO),有杀菌消毒作用.
"、"○"、"●"代表不同原子,产物D为次氯酸(HClO),有杀菌消毒作用.
①C物质的水溶液能使紫色的石蕊溶液变成 色,取C物质的水溶液少许,向其中加入稀硝酸和硝酸银溶液,观察到有白色沉淀产生,发生反应的化学方程式是 ,利用此法可检验自来水中是否含有Cl ﹣.
②液氯与水反应的化学方程式是 .
(4)天然水中微生物使有机物(以C 6H 10O 5表示)转化为CO 2和H 2O的过程中所需O 2的量叫做生化需氧量(BOD,单位为mg•L ﹣ 1),反应的化学方程式为:C 6H 10O 5+6O 2 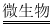 6CO 2+5H 2O,测得20℃时1L某天然水样中含有机物(C 6H 20O 5)的质量为10.8mg,则该水样的BOD值是多少?(写出计算过程)
6CO 2+5H 2O,测得20℃时1L某天然水样中含有机物(C 6H 20O 5)的质量为10.8mg,则该水样的BOD值是多少?(写出计算过程)
掌握科学的研究方法,探索化学世界的奥秘.
(1)分类是学习化学的重要方法之一.
①生活中,常会接触到下列物质:
A.铜丝 B.甲烷 C.过氧化氢 D.碘酒
其中属于混合物的是(填字母,下同) ,属于氧化物的是 .
②根据物质在转化过程中的特点,可将化学反应分为化合反应,分解反应、置换反应和复分解反应四种基本反应类型,下列转化不属于这四种基本反应类型的是 .
A.生石灰与水反应 B.一氧化碳还原氧化铁 C.中和反应
(2)实验是学习化学的一条重要途径,实验室中可用KClO 3在MnO 2催化下受热分解制取氧气,并将反应后的混合物进行分离回收,实验操作如图所示(MnO 2难溶于水)

①图A中试管口略向下倾斜的原因是 ,图B操作中玻璃棒的作用是 .
②图C操作中的一处明显错误是 ,图D操作中,当看到 ,停止加热.
(3)质量守恒定律是帮助我们学习的认识化学反应实质的重要理论.
①下列表述正确的是
A.蜡烛燃烧后质量减小,说明质量守恒定律不是普遍规律
B.每32g S和32g O 2完全反应后,生成64g SO 2
C.在化学反应aA+bB=cC+dD中一定有:a+b=c+d
②有机化合物R与足量氧气置于密闭容器中充分反应生成CO 2和H 2O,实验测得反应前后物质的质量如下表:
| |
R |
O 2 |
CO 2 |
H 2O |
| 反应前质量/g |
46 |
128 |
0 |
0 |
| 反应后质量/g |
0 |
32 |
x |
54 |
则x= ,已知参加反应的物质R与氧气的分子个数之比为1:3,则R的相对分子质量是 .
泡腾片配料表如下:
成分 |
柠檬酸 |
碳酸氢钠 |
维生素C |
乳糖 |
色素香精 |
每片含量(4 g/片) |
未知 |
未知 |
0.2 g |
未知 |
极少量 |
泡腾片放入温开水中,浮于水面上,产生大量气泡,所得溶液喝起来酸甜可口。已知:柠檬酸的化学式为C6H8O7,相对分子质量为192;泡腾片溶于水时,碳酸氢钠刚好与柠檬酸完全反应,生成Na3C6H5O7。
(1)泡腾片在水中产生气体的化学式为 。泡腾片中柠檬酸与碳酸氢钠的质量比为 。
(2)称取5.00 g泡腾片放入200.00 g温开水中,待泡腾片完全溶解,不再产生气体后,测得溶液质量为203.68 g.通过计算确定泡腾片中柠檬酸的质量分数。
学习了金属的有关知识后,同学们知道了如何鉴别黄金和黄铜(铜锌合金,俗名“愚人金”)。某化学兴趣小组的同学为了进一步测定某黄铜的组成,称取了黄铜样品50g放入锥形瓶中,向其中分5次共加入250g稀硫酸,测得数据记录如下表。
次数 质量 |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
累计加入稀硫酸的质量/g |
50 |
100 |
150 |
200 |
250 |
累计产生气体的质量/g |
0.2 |
x |
0.6 |
0.7 |
0.7 |
回答下列问题:
(1)x= ,该样品中铜的质量为 g。
(2)请在如图中画出样品中加入250g稀硫酸,产生气体的质量与稀硫酸的质量变化关系示意图。

(3)黄铜样品与稀硫酸恰好完全反应时,所得溶液的溶质的质量分数是多少?(精确到0.01)
工业上用闪锌矿(主要含ZnS,还含PbS等杂质)制备锌的流程如图1(部分产物略去):
(1)X的化学式是 ,图1中用过量空气的目的是 。
(2)①~④中属于化合反应的是 。
(3)Zn (填“能”或“不能”)与PbCl2溶被反应。
(4)写出反应③中生成ZnO的化学方程式 。
(5)结合下表数据设计:从粗锌中分离出纯锌的方案是 。
物质 |
Zn |
Pb |
C |
沸点℃ |
907 |
1749 |
4827 |
(6)反应②中固体质量随反应时间的变化图示如图,计算产生Y的质量。(写出必要的计算过程)

黑火药由硝酸钾、硫磺和木炭组成,爆炸时主要反应的化学反应方程式:
2KNO3+S+3C +N2↑+3CO2↑
+N2↑+3CO2↑
(1)反应涉及的物质中,属于空气主要成分的是
(2)横线上的物质由离子构成,阴离子的符号是
(3)黑火药制作的烟花燃放时,产生的空气污染物有 、 (固体和气体污染物,各填一种)
(4)硝酸钾分解的化学方程式为:2KNO3=2KNO2+O2↑.根据化学反应方程式计算,生成24g氧气需硝酸钾的质量是多少?
化学兴趣小组用一瓶久置的过氧化氢溶液制取氧气并测量过氧化氢质量分数。称量68g过氧化氢溶液和0.1g二氧化锰进行实验,反应前后质量随时间变化关系如图。计算:
(1)制得氧气的质量是 g。
(2)过氧化氢质量分数是多少?
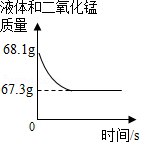
实验室有一瓶失去标签的过氧化氢溶液,为测定其溶质质量分数,兴趣小组同学取l00g该溶液与1g二氧化锰混合,使其充分反应,产生气体的质量和反应时间关系如图。
(1)完全反应后,经过滤、烘干,得到固体的质量为 (不计操作过程中的损耗)
(2)产生气体的速度越来越慢的原因是 。
A.二氧化锰越来越少
B.过氧化氢溶液的溶质分数越来越小
C.温度越来越高
(3)计算所用过氧化氢溶液的溶质质量分数。(规范写出计算过程)
