小明同学欲测定某纯碱样品(含少量氯化钠)中碳酸钠的质量分数,取26.5g该纯碱样品加入到100g水中,使其完全溶解,再加入169.3g稀盐酸,恰好完全反应,得到287g不饱和溶液。请计算:
(1)纯碱样品中碳酸钠的质量分数
(2)反应后得到的不饱和溶液中溶质的质量分数。
有一份铜锌合金粉末样品(设只含铜、锌),为认识其组成等,某学习小组进行了以下探究,请参与并完成有关计算:
(1)取样品20g和足量稀硫酸充分混合,待反应完全后过滤,将滤渣洗涤,干燥后称得其质量为13.5g。该样品中铜的质量分数为 。
(2)再取三份不同质量的样品,分别加入到三份100g相同浓度的硫酸溶液中,充分反应后,测得的数据如下表:
| 实验序号 |
① |
② |
③ |
| 样品的质量/g |
10 |
20 |
30 |
| 生成气体的质量/g |
0.1 |
0.2 |
0.25 |
试计算所用硫酸溶液的溶质质量分数(写出计算过程,结果精确到0.01%)。
黄铜是铜和锌的合金。某化学兴趣小组的同学欲测定实验室中某黄铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程。称量10g粉末状黄铜样品放入烧杯中,量取45mL稀硫酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
| |
第一次 |
第二次 |
第三次 |
| 加入稀硫酸的体积(mL) |
15 |
15 |
15 |
| 生成氢气的质量(g) |
m |
0.04 |
0.02 |
试求:
(1)m的数值 。
(2)此黄铜样品中铜的质量分数是少?(写出计算过程)
钼是一种重要的金属,用它制成的合金有良好的机械性能,在工农业生产和国防上都有广泛的用途。如图是利用钼矿石(主要成分为MoS 2)制备金属钼的流程图:
信息:MoO 3+3H 2 Mo+3H 2O

请回答下列问题:
(1)反应①常将钼矿石粉碎,目的是 ;MoO 3中钼元素的化合价为 。
(2)操作Ⅰ的名称是 ;常用NaOH溶液吸收反应①的尾气,化学方程式为 。
(3)制得19.2吨金属钼,理论上至少需含MoO 380%的粗产品多少吨?请写出计算过程。
注:粗产品杂质中不含钼元素
NaOH是重要的化工原料,研究其制备、检验、贮存及应用具有重要意义。
(1)工业上常用电解饱和食盐水的方法制取NaOH,反应的化学方程式为2NaCl+2H 2O 2NaOH+Cl 2↑+X↑.X的化学式为 。
(2)为了探究NaOH样品中是否存在NaCl、Na 2CO 3杂质,设计如下实验方法 
注:AgCl是白色固体,难溶于水和稀HNO 3
①乙中有无色无味气体产生,证明样品中含有Na 2CO 3.产生气体的化学方程式为 。
②试剂X为 溶液;可证明NaCl存在的现象是 。
(3)某兴趣小组试图通过测定生成的CO 2质量,确定因久置而变质的NaOH固体中Na 2CO 3的质量分数,设计了图所示装置并进行如下实验:
步骤一:取一定质量的样品,加入气密性良好的锥形瓶中,然后在分液漏斗中加入足量的稀硫酸,称出装置总质量为m 1。
步骤二:打开分液漏斗旋塞,逐滴加入稀硫酸,待气泡不再产生时,关闭旋塞,称出装置总质量为m 2。

①球形干燥管中不用NaOH固体而用CaCl 2固体的原因是 。
②小明同学认为(m 1﹣m 2)即为生成的CO 2质量,小红同学认为小明的想法不合理,理由是 。
(4)某工厂化验室用20%NaOH溶液洗涤一定量石油产品中残余H 2SO 4,共消耗NaOH溶液20g,洗涤后的溶液呈中性。这一定量石油产品中所含H 2SO 4的质量为 (写出计算过程,否则不得分)。
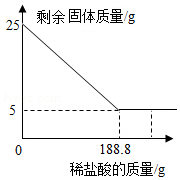
实验室常用大理石和稀盐酸制取二氧化碳。现取25g含碳酸钙的大理石于烧杯中,缓慢加入稀盐酸(大理石中的杂质不溶于水,也不与稀盐酸反应),剩余固体质量与加入稀盐酸的质量关系如图。求:
(1)25g大理石中碳酸钙的质量。
(2)恰好完全反应时所得溶液中溶质的质量分数。
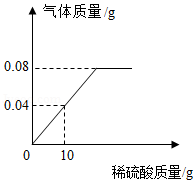
向盛有一定质量铁粉的烧杯中逐滴加入稀硫酸充分反应,产生气体质量与所加稀硫酸质量的关系如图所示。请根据该图信息计算:
(1)铁粉反应完时,产生氢气的质量为 g。
(2)原稀硫酸中溶质的质量分数(写出计算过程)。
文文想通过实验测定稀盐酸的溶质质量分数,他分四次向182.5g稀盐酸中加入含有杂质的锌粉(杂质不溶于盐酸也不与盐酸发生反应),记录所加锌粉质量与产生氢气的质量如下表所示:
次数 |
1 |
2 |
3 |
4 |
锌粉质量/g |
5 |
5 |
5 |
5 |
氢气质量/g |
0.15 |
0.15 |
0.1 |
0 |
请帮文文计算稀盐酸的溶质质量分数。
有镁和氯化镁固体混合物,取一定量的该混合物放入烧杯中,然后取稀盐酸200g,平均分五次加入其中,充分振荡,实验所得数据如下表:
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
|
加入稀盐酸的质量/g |
40 |
40 |
40 |
40 |
40 |
生成气体的总质量/g |
0.16 |
m |
0.48 |
0.5 |
0.5 |
(1)表中m的值为 。
(2)所用稀盐酸的溶质质量分数为多少?
实验室有一瓶含杂质的氯酸钾。某兴趣小组利用该药品和二氧化锰制取氧气(杂质不参加反应)。实验数据记录如图:

请回答下列问题:
(1)a= 。
(2)计算受热分解的氯酸钾的质量(精确到0.1g)。
现有一种稀盐酸和氯化铝的混合溶液,取100g该溶液于烧杯中,向其中逐滴加入氢氧化钾溶液,至氯化铝正好完全转化为沉淀,停止滴加氢氧化钾溶液,经测定,生成沉淀的质量为7.8g。请回答:
(1)据观察,产生沉淀前,消耗了一定量的氢氧化钾溶液,请写出该反应的化学方程式 。
(2)100g混合溶液中氯化铝的质量分数是多少?(写出计算过程,计算结果精确到小数点后两位。产生沉淀的化学方程式:AlCl3+3KOH=Al(OH)3↓+3KC1)
将20.0g铜锌合金置于烧杯中,向其中逐渐加入稀硫酸。当加入148.4g稀硫酸时,不再有气体生成,此时测得烧杯中混合物的质量为168.0g。
(1)反应中生成气体的质量是 g;
(2)求反应后烧杯溶液中溶质的质量分数。(写出计算过程)
现有一种稀盐酸和氯化铝的混合溶液,取100g该溶液于烧杯中,向其中逐滴加入氢氧化钾溶液,至氯化铝正好完全转化为沉淀,停止滴加氢氧化钾溶液,经测定,生成沉淀的质量为7.8g。请回答:
(1)据观察,产生沉淀前,消耗了一定量的氢氧化钾溶液,请写出该反应的化学方程式 。
(2)100g混合溶液中氯化铝的质量分数是多少?(写出计算过程,计算结果精确到小数点后两位。产生沉淀的化学方程式:AlCl 3+3KOH=Al(OH) 3↓+3KC1