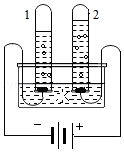
氢气是理想的清洁、高能燃料。水分解可获得氢气和氧气。
(1)图中,产生氢气的试管是 (填“1”或“2”)。
(2)我国开发出一种新型催化剂,实现了在光照下分解水,反应的化学方程式为 。
实验室用如图装置制取CO2。
(1)反应的化学方程式为 。
(2)用向上排空气法收集CO2的原因是 。

用如图装置进行实验(夹持仪器略去)。
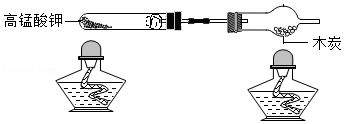
(1)高锰酸钾分解的化学方程式为 。
(2)木炭遇O2燃烧时,现象为 。
为保护绿水青山,可将工业残留的钡渣(主要成分为碳酸钡(BaCO3))进行无害化处理,制取化工原料硫酸钡(BaSO4)。主要流程如下:
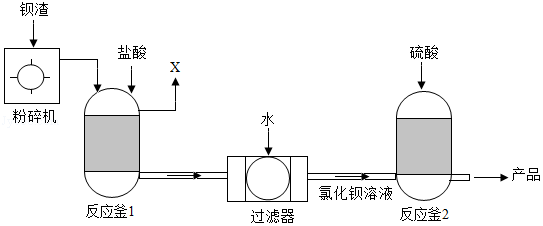
已知:BaSO4难溶于水,氯化钡(BaCl2)可溶于水。
(1)粉碎钡渣的目的是 。
(2)反应釜1中的气体X为 。
(3)反应釜2中发生复分解反应的化学方程式为 。
炼铁的主要原料是赤铁矿(主要成分是Fe2O3)、焦炭、空气等,转化过程如图:

(1)②中,反应为CO2+C 2CO,其中化合价发生改变的元素是 。
(2)③中,CO与Fe2O3反应的化学方程式为 。
H2O2可作增氧剂。常温下,用4% H2O2溶液进行实验,研究pH对H2O2分解所得溶液中溶氧量的影响,测定结果如图。
(1)H2O2分解的化学方程式为 。
(2)分析如图得到的结论是 。

利用下图装置进行实验(两支玻璃管内径相同).实验前K 1、K 2、K 3均已关闭。
| 实验装置 |
【实验1】制备气体 |
【实验2】测定空气中氧气含量 |
| |
左管中带孔的燃烧匙盛有足量锌粒,右管盛有稀硫酸 Ⅰ.打开K 1和K 2,使反应发生 Ⅱ.在K 1的导管口处收集气体 Ⅲ.… |
左管中燃烧匙盛有足量白磷,右管盛有水 Ⅰ.光照引燃白磷 Ⅱ.待白磷熄灭,冷却,打开K 2,至液面不再变化,右管中液体的高度为h 1 |
(1)实验1:锌与稀硫酸反应的化学方程式为 ;为使反应停止,Ⅲ中的操作是 。
(2)实验2:打开K 2,右管中液面下降,原因是 ;计算空气中氧气体积分数的表达式为 (用h 0、h 1表示)。
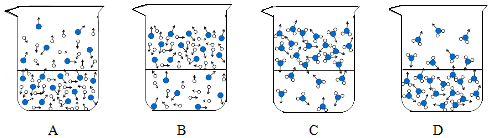
载人航天器工作舱中的空气要与地球上的空气基本一致。
资料:在同温同压下,气体的体积之比等于分子个数之比。
(1)用微观示意图表示工作舱中空气的主要成分,图中最合理的是 (填序号)。

(2)宇航员呼出的CO2用氢氧化锂(LiOH)吸收,生成Li2CO3和H2O,反应的化学方程式为 。
(3)航天器返回地面后,用Ca(OH)2与Li2CO3发生复分解反应,使 (填化学式)再生。
2017年5月我国海域可燃冰试采获得成功。可燃冰(天然气水合物)是资源量丰富的高效清洁能源,能释放出天然气。
(1)生活中,可以利用天然气(主要成分是甲烷)获得热量。甲烷燃烧的化学方程式为 。
(2)工业上,可以利用甲烷获得氢气,其反应的微观示意图如图:

①图1所示反应的化学方程式为 。
②在图2横线处补全相应微粒的图示。
葡萄的果肉和果皮中都含有丰富的营养物质。
(1)为使葡萄果实饱满、提高含糖量,在葡萄生长的中后期可适当施加硫酸钾、过磷酸钙等肥料,其中硫酸钾属于化学肥料中的 肥。
(2)用硫酸铜配制的农药波尔多液,可以防治葡萄生长中的病害。溶解硫酸铜时不宜用铁制容器,用化学方程式表示其原因: 。
(3)食用葡萄前要清洗干净,如图是一种清洗的方法。 
下列说法正确的是 (填序号)。
| A. |
面粉有利于去除葡萄皮上的脏东西 |
| B. |
清洗干净后,建议吃葡萄不吐葡萄皮 |
| C. |
葡萄富含糖类物质,糖尿病人不宜多食。 |
Ba(NO 3) 2可用于生产信号弹、炸药等。利用钡泥(主要含有BaCO 3、BaSO 3、Fe 2O 3)可制取Ba(NO 3) 2,其部分流程如图:
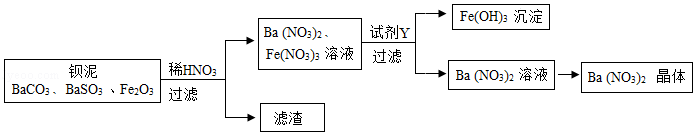
(1)Ba(NO 3) 2中钡元素的化合价为 ;流程中所涉及的氧化物是 (填1种即可)。
(2)BaCO 3与稀HNO 3反应的反应类型是 ;写出Fe 2O 3与稀HNO 3反应的化学方程式: 。
(3)试剂Y为 (填序号)。
①BaCl 2溶液 ②Ba(OH) 2溶液 ③NaOH溶液
(4)从Ba(NO 3) 2溶液中析出Ba(NO 3) 2晶体的方法是 。
如图是实验室中常见装置,回答下列问题。

(1)仪器a的名称是 。
(2)用装置A进行实验时,首先应 (填序号)。
①加药品
②加热
③检查装置气密性
(3)用A装置制取气体的不足之处是 。
(4)若要收集干燥的CO 2,可将含有水蒸气的CO 2从装置B的 (填"m"或"n")端导入,试剂X是 ;再用装置 (填"C"或"D"或"E")收集。
(5)向集满CO 2的集气瓶中加入澄清石灰水,反应的化学方程式为 。
某兴趣小组在相同条件下,将10.00g下列物质分别置于相同规格的烧杯,并敞口存放于空气中,烧杯中物质质量随时间变化如表,回答下列问题。
| 时间 |
质量/g |
|||||
| |
水 |
饱和石灰水 |
稀盐酸 |
浓硫酸 |
氯化钠浓溶液 |
氯化钙浓溶液 |
| 1天 |
8.16 |
8.37 |
8.64 |
11.18 |
9.38 |
10.25 |
| 2天 |
5.76 |
5.94 |
6.69 |
12.55 |
8.47 |
10.33 |
(1)下列图示能反映水在空气中放置时发生变化的微观示意图是 (填字母序号)
(图中  表示氧原子,○表示氢原子)
表示氧原子,○表示氢原子)
(2)石灰水在空气中久置后有浑浊现象,写出该反应的化学方程式 。
(3)为研制一种安全、环保的除湿剂,可选择上表中的 (填溶质的化学式)。
(4)将10.00g氯化钠浓溶液敞口久置后,最终得到2.26g晶体,则该溶液是 (填"饱和"或"不饱和")溶液。(已知该温度下氯化钠的溶解度为36.1g)
(5)为进一步研究稀盐酸敞口久置后浓度变化,该小组开展如下探究。
①甲同学猜想浓度可能会变大,理由是 。
②为验证甲同学的猜想是否正确,设计实验方案: 。
(6)乙同学取20%的氢氧化钠溶液20.00g,敞口放置一段时间后部分变质,得到18.80g溶液,由此能否计算所得溶液中溶质组成?若能,请计算其组成;若不能,请补充完成实验方案设计,同时说明需要测定的数据(用a表示),并计算a的取值范围。(不要求写出计算过程)
废旧电路板中主要含有塑料、铜和锡(Sn)等,为实现对其中锡的绿色回收,某工艺流程如下。

已知:Sn+SnCl 4═2SnCl 2
(1)SnCl 4中锡元素的化合价是 。
(2)铜的金属活动性比锡的 (填"强"或"弱"),固体A中一定含有的金属元素是 。
(3)写出步骤②发生反应的化学方程式 。
(4)相比于直接焚烧废旧电路板回收金属,该工艺主要优点是 (回答一点即可)。