将化学物质进行合理分类是研究物质及其变化的常用方法。
(1)以下物质的分类对于预测其化学性质没有帮助的是 (填标号)。
A.二氧化硫属于非金属氧化物
B.锌属于“氢前金属”
C.氢氧化锰属于白色固体
D.硫酸亚铁属于硫酸盐
(2)碳酸锂(Li2CO3)广泛应用于陶瓷和医药等领域,是一种微溶于水的白色固体。结合所学知识预测,Li2CO3能与 (填物质类别)反应,验证预测的实验操作与预期现象是:取Li2CO3固体于试管中, 。
(3)依据各类物质之间的反应规律,设计两种制备Li2CO3的方案(要求依据两种不同的反应规律)。完成表:
方案 |
原料1 |
原料2 |
预期反应的化学方程式 |
依据的反应规律 |
① |
Li2SO4溶液 |
|
|
两种盐反应生成两种新盐,生成物中有沉淀。 |
② |
|
|
|
|
人类历史发展的不同阶段曾以不同金属材料的使用作为标志。

(1)金、银在自然界有单质形式存在,说明他们的化学性质都 。
(2)在生产生活实践中,人类逐渐掌握了多种金属的冶炼技术。
①)比较两种铁矿石磁铁矿(主要成分Fe3O4)和菱铁矿(主要成分FeCO3),从化学的角度分析“磁铁矿作炼铁原料更具优势”,其原因是 。
②近代工业上采用电解熔融氧化铝(A12O3)的方法冶炼铝,Al2O3分解后得到两种单质,该反应的化学方程式为 : 。
(3)镁铝合金被誉为“21世纪绿色金属结构材料”。一种镁铝合金Mg17All2是特殊的储氢材料,完全吸收氢气后得到MgH2和Al,该反应的化学方程式为 。
(4)钛和钛合金是21世纪的重要的金属材料。钛合金制品放在海水中数年,取出后仍光亮如新,是因为其 (填字母序号)非常好。
A.可塑性 B.机械性能 C.抗腐蚀性能
(5)铁在潮湿的空气中反应生成疏松的铁锈。已知:2FeCl3+Fe=3FeC12
①铁锈的主要成分是 (填化学式):将生锈的铁制品放入一定量的稀盐酸中充分反应,变化过程中最多涉及 种化学反应基本类型。
②将10g表面生锈的铁钉(杂质已忽略)浸泡在100g溶质质量分数为7.3%的稀盐酸中充分反应,观察到铁锈已完全消失。反应停止后,取出光亮的铁钉洗涤、干燥、称量,质量为3.6g。则原锈铁钉中铁元素的质量分数为 。
(6)利用“活泼金属”可以制得H2,H2可用作汽车能源。若推广应用于汽车产业,则需综合考虑的因素有 (填字母序号)。
A.金属原料的成本 B.生成过程中的能耗和污染 C.金属的回收利用
NaOH是重要的化工原料,研究其制备、检验、贮存及应用具有重要意义。
(1)工业上常用电解饱和食盐水的方法制取NaOH,反应的化学方程式为2NaCl+2H 2O 2NaOH+Cl 2↑+X↑.X的化学式为 。
(2)为了探究NaOH样品中是否存在NaCl、Na 2CO 3杂质,设计如下实验方法 
注:AgCl是白色固体,难溶于水和稀HNO 3
①乙中有无色无味气体产生,证明样品中含有Na 2CO 3.产生气体的化学方程式为 。
②试剂X为 溶液;可证明NaCl存在的现象是 。
(3)某兴趣小组试图通过测定生成的CO 2质量,确定因久置而变质的NaOH固体中Na 2CO 3的质量分数,设计了图所示装置并进行如下实验:
步骤一:取一定质量的样品,加入气密性良好的锥形瓶中,然后在分液漏斗中加入足量的稀硫酸,称出装置总质量为m 1。
步骤二:打开分液漏斗旋塞,逐滴加入稀硫酸,待气泡不再产生时,关闭旋塞,称出装置总质量为m 2。

①球形干燥管中不用NaOH固体而用CaCl 2固体的原因是 。
②小明同学认为(m 1﹣m 2)即为生成的CO 2质量,小红同学认为小明的想法不合理,理由是 。
(4)某工厂化验室用20%NaOH溶液洗涤一定量石油产品中残余H 2SO 4,共消耗NaOH溶液20g,洗涤后的溶液呈中性。这一定量石油产品中所含H 2SO 4的质量为 (写出计算过程,否则不得分)。
化学知识与应用
(1)铝制品耐腐蚀的原因是 (用化学方程式表示);
(2)在牙膏中,常用轻质碳酸钙粉末作摩擦剂。人们通常用下列方法生成轻质碳酸钙:将石灰石煅烧后加水制成石灰乳,净化后与二氧化碳作用得到碳酸钙。试用化学方程式表示上述反应的原理:
① ; ② ;③ 。
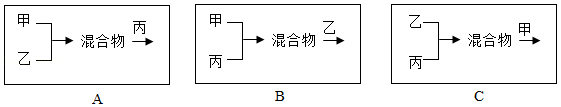
化学试剂厂三个车间排放的废液中分别含有的溶质如下:
甲 |
乙 |
丙 |
Ba(OH)2、NaOH |
NaCl、Na2CO3 |
HCl、NaCl |
按照不同的方式处理,可以得到不同化学产品,从而充分利用资源,变废为宝。
(1)方案一,甲车间废液中加入适量的Na2CO3 溶液,可分离回收Ba(OH )2 和 NaOH,写出该反应的化学方程式 ;
(2)方案二,乙、丙两车间的废液按适当比例混合后,可得到一种溶质为 的中性溶液;
(3)方案三,将三个车间的废液样品混合,过滤。得到无色溶液和白色沉淀。无色溶液中一定含有NaCl,为确定可能含有的溶质,设计下列实验,其中能达到目的是
A. 若只加入MgSO4 溶液,能观察到明显现象
B. 若加入过量的Na2CO3 溶液后,再滴加石蕊溶液,都能观察到明显现象
C. 若加入过量的中性BaCl2 溶液后,再滴加酚酞溶液,都能观察到明显现象
(4)方案四,按照下列方式将三个车间的废液按适当比例混合(假设能反应的物质均恰好完全反应,且中间过程未过滤),最终只生成BaCO3 沉淀和NaCl 溶液的是