火是文明的起源,取火的方法经过了漫长的演变过程。
(1)古代人使用的“火折子”吹气即可燃,“火折子”的制作材料中有硫磺。硫燃烧的化学反应方程式为 。
(2)1830年,法国人发明了摩擦火柴,将白磷、硫、KClO3、MnO2混合做火柴,摩擦生热使白磷燃烧,利用白磷燃烧的热量使KClO3分解,然后是硫燃烧。该过程中KClO3分解的化学反应方程式为 。推测摩擦过程中白磷比硫先燃烧的原因是 。
(3)19世纪中期,瑞典人创制出安全火柴,将红磷涂在火柴盒的摩擦面上,硫、KClO3、MnO2则藏于火柴头中。火柴划燃的瞬间,火苗异常旺,对产生此现象的原因推测不合理的是 (填序号)。
A.火柴头里的硫比火柴梗燃烧更剧烈
B.MnO2分解产生氧气助燃
C.KClO3分解产生氧气助燃
化学的学科特征是在原子、分子水平上研究物质和创造物质。请从微观的角度回答下列问题。
(1)物质的结构决定性质。
①根据Na、Al原子结构图Na  、Al
、Al 可推知,金属Na、Al的化学性质不同的原因是 。
可推知,金属Na、Al的化学性质不同的原因是 。
②CO和CO2化学性质不同的原因是 。
③稀盐酸和稀硫酸都可使紫色石蕊试剂变红,原因是 。
(2)如图是氢气在氧气中燃烧的微观示意图(图中“o”代表氢原子。“●”代表氧原子)。

①参加该化学反应的最小粒子是 ( 填微粒符号)。
②写出该反应的化学方程式 。
实验室现有稀硫酸、稀盐酸、石灰石、锌片等药品及相关仪器,请结合如图的装置回答问题:

(1)写出如图中标有序号的仪器名称:① ;② 。
(2)欲用装置F收集氢气,应该从装置F的 (填“a”或“b”) 端通入气体。
(3)某气体只能用E装置收集,则该气体不能具有的性质是 (填序号)。
A.易溶于水或与水反应
B.能与空气反应
C.密度与空气接近
(4)若用如图中的装置制取二氧化碳,选择的装置组合是 (填字母),该反应的化学方程式是 。
金属在生产、生活和社会发展中的应用较为广泛。
(1)铜丝、铝丝常用作导线,是因为它们具有良好的 性。
(2)早在明代宋应星所著的《天工开物》里就对铁器的生产和使用有所记载,到了现代,炼铁技术得到进一步发展。炼铁的原理是利用一氧化碳与氧化铁的反应,请写出该反应的化学方程式 ,该反应 (填“属于”或“不属于”)置换反应。
(3)钢窗表面喷漆不仅美观,而且可有效防止铁与空气中的 接触而生锈。
(4)某同学对含X、Y、铜、银四种金属的混合物进行如图探究,根据实验流程回答下列问题:
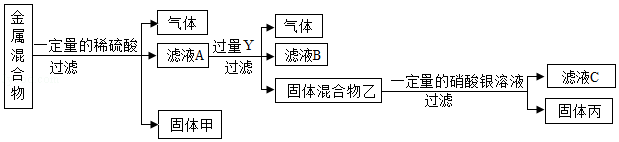
①四种金属的活动性由强到弱的顺序是 ;
②滤液C中所含溶质的成分可能有 种情况。
阅读下列材料。
金属材料对于促进生产发展、改善人类生活发挥了巨大作用。钢是用量最大、用途最广的合金,根据其化学成分,可分为碳素钢和合金钢。根据含碳量不同,碳素钢可分为高碳钢、中碳钢和低碳钢,其性能和用途如图所示。

合金钢也叫特种钢,是在碳素钢里适量地加入一种或几种合金元素,使钢的组织结构发生变化,从而使钢具有各种特殊性能。
铝合金是目前用途广泛的合金之一,例如硬铝的密度小、强度高、具有较强的抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。将某种铝合金放入氢氧化钠溶液中,其中的铝会与氢氧化钠、水反应生成偏铝酸钠(NaAlO2)和一种可燃性气体。
近年来,为满足某些尖端技术发展的需要,人们又设计和合成了许多新型合金。例如:钛合金与人体具有很好的“相容性”,可以用来制造人造骨;耐热合金和形状记忆合金广泛应用于航空航天等。
回答下列问题:
(1)用量最大、用途最广的合金是 。
(2)钢的含碳量是 ;可用于制造器械、弹簧和刀具等的是 碳钢。
(3)用于制造飞机和宇宙飞船利用了硬铝 (填标号)的性质。
A.密度小
B.强度高
C.具有较强的抗腐蚀能力
D.硬而脆
(4)可以用来制造人造骨的是 合金。
(5)铝与氢氧化钠溶液反应的化学方程式是 。
复学防疫,化学助力。
(1)起床后,测体温。测体温时水银体温计中汞柱会上升的微观原因是汞原子 。
(2)上学时,戴口罩。制作口罩用的无纺布面料主要是聚丙烯[(C3H6)n],聚丙烯中碳、氢元素的质量比为 。
(3)到校后,勤消毒。过氧乙酸用于教室消毒,其化学性质不稳定,分解的化学方程式为:2C2H4O3═2C2H4O2+X↑,则X的化学式为 。用于手部消毒的酒精溶液属于易燃物,使用时要注意安全,酒精燃烧的化学方程式为 。
(4)用餐时,讲营养。如午餐仅食用米饭、红烧肉、鸡蛋汤、牛奶,从均衡营养角度出发还应补充的一种食物是 。
CO2的捕集与资源化利用是化学研究的热点。
(1)控制CO2的排放,是为了减缓 效应,加压水洗法可捕集CO2,是因为压强增大时CO2在水中的溶解度 (填“增大”“不变”或“减小”)。
(2)石灰石循环法可用于捕集烟气中的CO2,该方法以CaO捕集CO2,将所得产物在高温下煅烧可重新获得CaO,高温煅烧时反应的化学方程式为 ,生成的CaO疏松多孔,结构与活性炭相似,其在捕集过程中对CO2具有良好的 性。
(3)对CO2气体加压、降温,可获得干冰。从构成物质的微粒视角分析,该过程主要改变的是 。干冰能用于人工降雨,是因为 。
(4)CO2可用于食品保鲜,实验测得气体中CO2的体积分数与溶液pH的关系如图1所示。
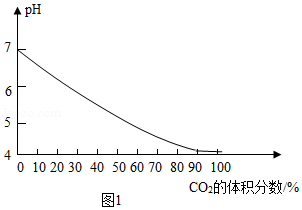
①气体中CO2体积分数增大时,造成图示变化的主要原因是溶液中 浓度增大(填化学式)。
②智能化食品包装通过颜色变化显示包装内CO2气体含量的变化,举出一种可通过颜色变化用于该智能化包装的物质 。
(5)已知一定条件下CO2与H2以质量比11:2反应可生成CH4.与该反应类似,不同条件下,CO2与H2反应也能生成甲醇(CH4O)。生成甲醇时参加反应的CO2与H2的质量比 。
(6)为研究某公园中植物与大气间的碳交换,对该公园一年内每天的气温及光合有效辐射进行测量,结果见图2和图3.通过测量其一年内每天空气中CO2含量等数据,分析所得碳交换的结果见图4.碳交换以每月每平方米植物吸收或释放CO2的质量表示,正值为净吸收CO2,负值为净释放CO2。

①由如图可推测,影响公园中植物与大气碳交换的因素有 。
②为进一步研究环境因素对公园中植物与大气碳交换的影响,从光合作用的角度出发,还需测量的重要因素是其一年内每天 的变化。
实验室可利用Zn与稀硫酸的反应制取H2。
(1)用浓硫酸配制稀硫酸的操作为 (填字母),用玻璃棒引流,并不断搅拌。
A.将浓硫酸缓缓注入盛有水的烧杯中
B.将水缓缓注入盛有浓硫酸的烧杯中
(2)Zn与稀硫酸反应的化学方程式为 。
(3)图1所示的仪器B、D的名称为 、 ,组装制取H2的发生装置应选用的仪器为 (填字母)。
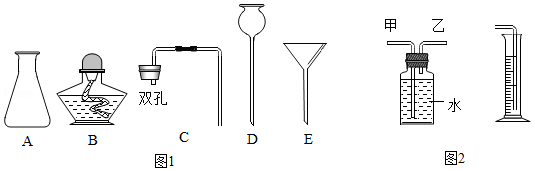
(4)为收集并准确测量H2的体积,在装入药品前,需检查装置的 。
(5)相同条件下H2密度比空气小,利用该性质可以通过 法收集H2,若用图2所示装置测量生成H2的体积,H2应从 (填“甲”或“乙”)管通入。
(6)为探究影响Zn与稀硫酸反应快慢的因素,进行以下三组实验,室温下,取颗粒大小相同的锌粒与足量的稀硫酸反应,测量产生10mL H2(通常状况)所需的时间,下表为实验数据:
实验编号 |
硫酸的质量分数/% |
硫酸的体积/mL |
锌粒的质量/g |
时间/s |
1 |
10 |
10 |
1 |
78 |
2 |
10 |
10 |
2 |
57 |
3 |
40 |
10 |
1 |
9 |
①比较实验1、2的数据,可以得出的结论是 。
②由实验数据可知,该实验中对Zn与稀硫酸反应快慢影响较大的因素是 。
③比较不同条件下锌粒与稀硫酸反应的快慢有不同的方法,除测量产生相同体积的H2所需的时间,还可采用的测量方法是 (写出一种)。
空气质量意味着生活质量。
(1)下表为某同学测量的呼吸前后气体组成的实验数据(通常状况)。
物质 |
吸入空气(体积分数/%) |
呼出气体(体积分数/%) |
氮气 |
78 |
75 |
氧气 |
21 |
16 |
二氧化碳 |
0.03 |
4 |
水蒸气 |
a |
b |
①氮气的化学性质比较 (填“稳定”或“活泼”),在呼吸前后没有发生变化,实验中呼出气体的总体积 吸入空气的总体积(填“>”“=”或“<”)。
②呼吸时消耗O2产生CO2,该过程 能量(填“吸收”或“释放”)。呼吸前后气体中水蒸气含量变化较大,实验中其体积分数b a(填“>”“=”或“<”)。
(2)汽车多以汽油为燃料,辛烷(C8H18)是汽油中的一种成分。
①每114g C8H18完全燃烧,需要消耗400g O2,生成mg CO2和162g H2O,则m= g。
②与完全燃烧相比,等质量的C8H18不完全燃烧时会产生CO,消耗O2的质量 (填“偏大”“相等”或“偏小”),除污染环境外,燃料不完全燃烧还会产生的问题是 浪费 (写出一种)。
(3)“远在高空是地球卫士,近在身边是健康杀手。”臭氧(O3)对环境的作用需辩证地认识。
①高空中臭氧层能吸收紫外线。有学者认为,致冷剂氟利昂进入高空大气后会产生氯原子(Cl•),引发以下反应:Cl•+O3═ClO•+O2 Ⅰ
2ClO•═2Cl•+O2 Ⅱ
Cl•加快了上述转化过程总反应的速率,但自身的质量和化学性质在总反应前后没有发生变化,其作用是 ,该转化过程总反应的化学方程式为 。
②地面附近的臭氧是一种空气污染物,臭氧属于 (填“单质”或“化合物”),O3可表示一个 (填“原子”“分子”或“离子”)。
(4)有人提出:你吸入的空气中的某个氧原子可能自于若干年前恐龙的身体。该说法表达的观点是 (填字母)。
A.分子聚集形成物质,分子在不停地运动
B.在化学变化中原子既不会产生,也不会消失
C.原子内部结构复杂,原子不是构成物质的最小微粒
扬州既是世界美食之都,更是一座拥有两千多年历史的文化旅游名城。
(1)扬州早点是一张靓丽的城市名片。

①扬州包子面皮如雪。面皮的主要成分为淀粉,淀粉属于 (填字母)。
A.糖类
B.油脂
C.蛋白质
②大煮干丝富含蛋白质。蛋白质在人体内转化为能被吸收的小分子化合物,这类化合物称为 。
③翡翠烧卖色泽翠润,所用天然色素来自新鲜绿色蔬菜。获取天然色素时,将菜渣与菜汁分离开可采用 的方法。
(2)青砖黛瓦诉说着扬州的历史。

①《天工开物》中介绍了烧制青砖的方法,其中载有“灌水其上”“水火既济”。相关反应为水蒸气与灼热的碳生成CO和一种气体单质,其化学方程式为 。
②古代建筑工匠常用糯米灰浆粘合墙砖,糯米灰浆由糯米汁、熟石灰和砂土等混合制成。糯米灰浆属于 (填“复合材料”或“金属材料”)。熟石灰的化学式为 ,在空气中熟石灰最终转化为 (填化学式)。
③“帘外芭蕉惹骤雨,门环惹铜绿。”铜绿是铜发生一系列复杂反应的产物,空气中参与该反应过程的物质有 (填化学式)。
化学在抗击新冠肺炎中发挥重要作用。
(1)医用口罩熔喷布所用的聚丙烯塑料属于 (填“复合”或“合成”)材料。
(2)某中药中含有的金丝桃苷(C21H20O12)在与病毒的主要蛋白酶的对接方面有一定效果,金丝桃苷中碳、氢、氧的原子个数比为 。
(3)呼吸机提供的氧气来自于空气,分离液态空气获得氧气的变化属于 变化,在人体组织里,葡萄糖(C6H12O6)在酶的催化作用下经缓慢氧化转变成 。
(4)次氯酸钠(NaClO)是一种杀菌消毒剂。电解饱和食盐水可制得次氯酸钠和一种可燃性气体,反应的化学方程式为 ;用漂白粉[有效成分为Ca(ClO)2]制取次氯酸钠的反应为:Ca(ClO)2+X═CaCO3↓+2NaClO,X的化学式是 。
氢气被看作是理想的能源。氢气的制取和储存是氢能源利用领域的研究热点。
Ⅰ.氢气的制取
(1)科学家正致力于研究在催化剂和光照条件下分解水制氢气。写出该反应的化学方程式: ,该反应 (填“放出”或“吸收”)能量。
(2)水热分解可得氢气,高温下水分解体系中微粒含量与温度的关系如图所示。
图中曲线A、B对应的微粒依次是 (填符号)。
Ⅱ.氢气的储存
(3)一种镁铜合金可用于储氢。
①将镁、铜单质按比例在一定温度下熔炼得到上述合金。熔炼时须通入氩气,其目的是 。
②350℃时,该镁铜合金与氢气反应,生成了一种仅含Mg、H两种元素的化合物,其中氢元素的质量分数为7.7%.该化合物的化学式为 。
阅读下面的科普短文,回答相关问题。
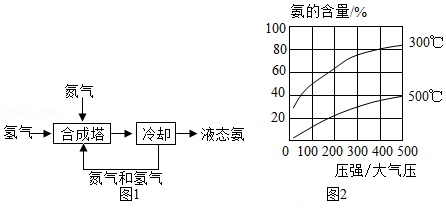
氨是一种重要的化学物质,可用于制造硝酸和氮肥,氨主要来自于人工合成。1909年,弗里茨•哈伯成功地利用氮气和氢气合成出氨。工业合成氨的流程如图1所示。
为了找到合成氨反应合适的催化剂,人们做了6500多次实验,发现铁触媒效果较好。在铁触媒作用下,用体积比为1:3的氮气和氢气合成氨,当容器中氨的含量不再发生变化时(平衡时),测得氨的含量分别与温度和压强的关系如图2所示。
1913年第一座合成氨工厂建立。如今全球合成氨年产量超千万吨,其中大约85%的氨用于生产氮肥,缓解了地球上有限的耕地资源与庞大的粮食需求之间的矛盾。
(1)工业上可用 方法获得合成氨的原料N2。
(2)甲烷和H2O高温下反应得到CO和原料气H2,该反应的化学方程式为 。
(3)从“合成塔”中出来的气体是 (填“纯净物”或“混合物”)。
(4)科学家研究合成氨反应催化剂的目的是 。
(5)按下列条件进行合成氨反应,平衡时氨的含量最高的是 (填字母)。
a.200大气压、300℃
b.200大气压、500℃
c.400大气压、300℃
d.400大气压、500℃
铝是大自然赐予人类的宝物,是现代文明不可缺少的物质基础。
(1)人类冶炼和使用金属铝的时间较晚,可能是因为 (填字母)。
a.地壳中铝元素含量少
b.冶炼铝的技术要求高
(2)用铝锂合金制造“神舟号”航天飞船的一些部件,主要是利用其强度高、耐腐蚀和 (写一条)等性质。高温下,铝与Li2O反应可置换出金属锂,写出该反应的化学方程式: 。
(3)用砂纸去除铝片表面的氧化膜。将其浸入硫酸铜溶液中,一段时间后,观察到铝片表面有红色物质析出,并有气泡产生,经检验气体为氢气。
①写出生成红色物质的化学方程式: 。
②硫酸铜溶液中的阳离子有 (填离子符号)。
(4)原子簇是若干个原子的聚集体,有望开发成新材料。某铝原子簇由13个铝原子构成,其最外层电子数的总和为40时相对稳定。写出该稳定铝原子簇的微粒符号: 。
[铝原子的结构示意图为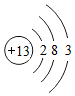 ]
]