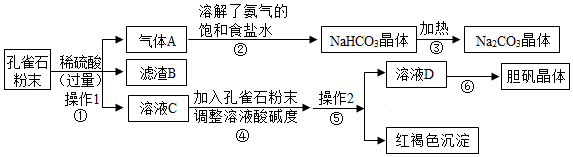
孔雀石主要成分为Cu2(OH)2CO3,还含有少量Fe2O3、SiO2(难溶于水,不与酸反应)等杂质。某学习小组探究孔雀石综合利用的流程如图
请回答下列问题:
(1)操作1、操作2均为 操作,此操作中玻璃棒的作用是 和引流。
(2)C中的溶质有:H2SO4、Fe2(SO4)3和 (填化学式)。
(3)步骤②中发生反应的化学方程式为:NaCl+NH3+CO2+H2O=NaHCO3+ 。
(4)写出红褐色沉淀溶于稀硫酸的化学方程 。
在实验室中,我们常用如图所示装置制取和收集某些气体。

(1)写出a、b两种仪器的名称。a ,b为 。
(2)实验室若用KMnO 4制取O 2,写出其化学方程式 ,相应的发生装置为 (填字母代号)。
(3)若选用装置C制备CO 2,则可以选择 (填字母代号)。
a.块状碳酸钙和稀盐酸
b.块状碳酸钙和稀硫酸
(4)经查阅资料,Na 2O 2(过氧化钠)也能与水迅速反应产生O 2.补全下列反应方程式:2Na 2O 2+2H 2O═
(5)收集O 2适合选用 装置(填字母代号)。
a.仅D
b.仅E
c.D和E
如图所示为实验室中常见气体制备、净化、干燥、收集和进行实验探究的部分仪器,欲利用其进行下列化学实验。

(1)用单质锌和稀硫酸反应,制取氢气并进行氢气可燃性实验。在点燃氢气前,一定要注意检验 。
(2)以石灰石和稀盐酸为原料制取二氧化碳的化学方程式为 。制取、收集干燥的二氧化碳气体,并去除混有的少量HCl气体,所选仪器的连接顺序为 (从左至右填写仪器序号字母)(提示:挥发出的少量HCl气体可用饱和碳酸氢钠溶液吸收)。
(3)在实验室中以过氧化氢溶液为原料(二氧化锰作催化剂)制取氧气,并对某种塑料袋试样的组成元素进行分析探究(查阅资料知该塑料只含C、H两种元素),所选仪器按“A→E1→D→E2→B→碱石灰干燥管”的顺序连接(E1、E2为浓硫酸洗气瓶),实验前检验装置气密性。使一定质量的该塑料袋碎屑在氧气中充分燃烧,观察现象,收集有关实验数据(假设发生的化学反应都充分反应)。
①在该装置中,洗气瓶E1、E2的作用是 。
②仪器D的大玻璃管中放入的塑料袋碎屑质量为5.6g,加入的塑料袋碎屑充分燃烧后,测得仪器E2的质量增加7.2g,仪器B的质量增加17.6g,则在该塑料袋试样中,氢、碳两元素的质量之比为氢元素的质量:碳元素的质量= (填写最简整数比)。
氧是地壳中含量最多的元素,氧及其化合物是化学学习和研究的重要内容。
(1)如图氧原子结构示意图获得的信息,正确的是 (填标号)。
a. 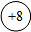 表示原子核,带8个单位正电荷
表示原子核,带8个单位正电荷
b.氧原子核外有2个电子层,有8个电子在核外作高速运动
c.氧原子在化学反应中易失去电子形成离子(O 2 ﹣)
(2)构成氧气的微粒是 ,氧气经降温和加压变为液态氧后体积变小,用微粒的观点解释: 。
(3)水是重要的氧化物,电解水实验说明水是由 组成的。登山和潜水供氧装置中,过氧化钠(Na 2O 2)与水反应,生成氢氧化钠(NaOH)和氧气,有关反应的化学方程式为 。
(4)自然界中氧循环的环节之一:绿色植物的光合作用,有关的化学方程式为6CO 2+6H 2O C 6H 12O 6+XO 2,则X= ,绿色植物通过光合作用将太阳能转化为 能。
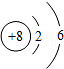
某化学小组从孔雀石[主要成分CuCO3•Cu(OH)2]中提取金属铜的实验步骤如下:将孔雀石粉碎,加过量稀硫酸,充分反应后过滤,向滤液中加入一种金属粉末。
(1)请填空:CuCO3•Cu(OH)2+2H2SO4═2CuSO4+CO2↑+3 。
(2)写出可以加入的一种金属并说明理由 。
石灰石和铁的化合物在生产、生活中有着广泛的应用.
(1)炼铁的原理是一氧化碳与氧化铁在高温条件下反应生成铁和二氧化碳,写出该反应的化学反应方程式 .
(2)牙膏中常用轻质碳酸钙粉末做摩擦剂.生产轻质碳酸钙的主要过程:①煅烧石灰石制得氧化钙; ②氧化钙加水制成石灰乳[主要成分是Ca(OH) 2]; ③石灰乳与二氧化碳反应得到碳酸钙.写出③的化学方程式 .
(3) 取62.5g含碳酸钙80%的石灰石(杂质不含钙元素且不参加反应)高温煅烧,一段时间后停止加热,测得剩余固体中钙元素的质量分数为40%,则生成的二氧化碳质量为 g.
(4)合成氨工业生产中所用到的催化剂是铁触媒,其主要的成分是FeO和Fe 2O 3,当FeO和Fe 2O 3中铁元素的质量比为1:2时,该催化剂的催化作用效果最好,此时FeO和Fe 2O 3的质量比为 (写最简比).
孔雀石的主要成分为Cu2(OH)2CO3,在加热条件下发生如下反应:Cu2(OH)2CO3 2R+CO2↑+H2O,请回答问题:
(1)R的化学式为 ;
(2)该反应属于 (填基本反应类型).
我国自主研制的首颗"碳卫星"将于2016年8月发射,主要任务是监测各地区二氧化碳的排放,为节能减排等宏观决策提供依据,请回答下列问题:
(1)大气中二氧化碳含量升高的一个主要原因是 燃料的大规模开发使用.
(2)固定和利用二氧化碳能有效减少空气中的温室气体.例如工业上利用CO 2和NH 3生产尿素的反应:CO 2+2NH 3  CO(NH 2) 2+X,则X的化学式为 .
CO(NH 2) 2+X,则X的化学式为 .
(3)下列行为符合"低碳生活,保护环境"这一理念的是 (填序号)
①焚烧纸质垃圾 ②步行上学 ③用电动牙刷刷牙.
84消毒液是一种无色或者淡黄色具有刺激性气味的含氯消毒剂,有效成分为次氯酸钠(NaClO)。广泛用于医院、宾馆、旅游、家庭等的卫生消毒。某化学兴趣小组对该消毒液进行了如下系列探究。
【查阅资料】
Ⅰ84消毒液不稳定,其杀菌作用主要依靠有效氯,有效氯越高杀菌效果越好。
Ⅱ消毒杀菌就是使病毒蛋白质变性,鸡蛋中蛋白质发生变性反应时变成白色固体。
探究一:84消毒液中有效氯含量的稳定性
0.5%的84消毒液在不同温度、不同存放时间下的有效氯含量:
| 存放时间 (小时) |
不同温度下,有效氯存留率 |
|
|
|
| 60℃ |
70℃ |
80℃ |
90℃ |
|
| 0(对照) |
100% |
100% |
100% |
100% |
| 3.0 |
…… |
…… |
94.66% |
88.05% |
| 6.0 |
…… |
96.66% |
89.67% |
74.69% |
| 12.0 |
…… |
93.32% |
82.62% |
…… |
| 20.0 |
94.75% |
…… |
…… |
…… |
| 20.0 |
92.99% |
…… |
…… |
…… |
【解释与结论】
(1)次氯酸钠(NaClO)中Cl元素的化合价为 。
(2)综合分析探究一中数据,在其他条件不变时,0.5%的84消毒液有效氯存留率受温度和时间的影响,其影响的变化趋势是 ,因此保存84消毒液应注意的问题是 。
探究二:不同浓度84消毒液的杀菌效果
在四只试管中各加入鸡蛋液2mL,分别加入不同浓度的消毒液,静置15分钟后,记录如下:
| 序号 |
2﹣1 |
2﹣2 |
2﹣3 |
2﹣4 |
| 实验操作 |
加入0.5mL消毒原液 |
加入0.5mL清毒 原液,12.5mL水 |
加入0.5mL消毒原液,50mL水 |
加入0.5mL消毒原液,100mL水 |
| 现象 |
液体表面产生气泡,无其他现象 |
液体中产生大量白色固体 |
液体中产生少量白色固体 |
液体中产生极少量白色固体 |
【解释与结论】
(3)探究二中杀菌效果最好的一组实验为 (填序号)。
(4)洁厕灵主要成分是盐酸,与84消毒液混合会产生有毒气体Cl 2,完成反应的化学方程式:2HCl+NaClO═Cl 2↑+H 2O+ 。
水是常用溶剂,某同学进行如图实验。
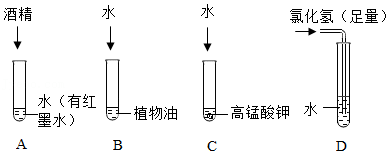
(1)倾斜A试管,沿内壁缓缓加入乙醇,不振荡,现象是 。
(2)实验可知,溶质状态可以是 。
(3)实验结束后,用洗涤剂洗净B试管,原理是 。
(4)C、D试管的废液倒入废液缸中产生了黄绿色气体,查阅资料可知:2KMnO4+16HCl(浓)═2KCl+2X+5Cl2↑+8H2O,X的化学式为 。
(5)询问老师得知用2NaOH+Cl2═NaCl+NaClO+H2O可处理Cl2。根据化学方程式计算,处理0.142g Cl2至少需NaOH的质量是多少?
为了测定一瓶未密封保存的NaOH固体中NaOH的质量分数,小科采用沉淀法进行如下操作:①取15克样品于烧杯中,加足量水配成溶液;②在样品溶液中加入足量的BaCl2溶液;③待反应完全后,过滤。有关数据记录如表:
反应前 |
反应后 |
|
烧杯和样品溶液总质量/g |
加入的氯化钡溶液质量/g |
过滤后烧杯和溶液总质量/g(滤液的损失忽略不计) |
95 |
65 |
140.3 |
请回答下列问题:
(1)在反应前后的溶液中,下列元素质量保持不变的是
A.钠元素
B.碳元素
C.钡元素
D.氧元素
(2)反应共生成沉淀 克
(3)原样品中NaOH的质量分数是多少?
浓硫酸具有脱水性,能把小木棍、蔗糖等中的氢元素和氧元素“脱出”结合生成水。
(1)用小木棍蘸取浓硫酸少许,一段时间后,小木棍上出现的实验现象是 。
(2)在蔗糖(C12H22O11)分子中,氢、氧原子个数比是 ,如果蔗糖完全脱水,则生成C和H2O的质量比是 。
阅读下列科普短文.
根据短文回答以下问题:
提到炸药,同学们可能会想到战争和暴力,但炸药的发明却促进了工业和经济的进步.我国是最早发明火药的国家,黑火药是我国古代的四大发明之一,主要分为硝酸钾、硫、木炭等.黑火药经点燃,发生剧烈燃烧,反应原理为:2KNO 3+S+3C K 2S+N 2↑+3CO 2↑
黑火药经阿拉伯传到欧洲,随后各国化学家陆续研制出各种炸药,如意大利化学家索布雷罗发明的硝化甘油,爆炸时威力很大,但安全性很低.瑞典化学家诺贝尔在前人研究的基础上,经过反复实验,研制出安全性很高的硝化甘油炸药,提高了它的利用价值.炸药的研发还在继续,安全烈性炸药不断问世,如TNT、黑索金等.
黑火药推动了炸药的快速发展,它虽然已退出军事领域,但依然发挥着重要的民用价值,如制造焰火、定向爆破等.我国近年来研制的纳米级黑索金,在理论和实验制备等方面获得了突破,将会继续在工业和军事领域做出贡献.
(1)黑火药不需外界提供氧气也可以发生爆炸,这是因为其成分中的 生成氧气的结果.
(2)通过阅读,下列说法正确的是 (填字母,符合题意的选项都选).
a.黑火药作为一种古老的炸药,现在已停止使用
b.黑火药能发生爆炸与它燃烧后生成气体并放出热量有关
c.使用危险物质时,我们应采取一些措施提高其安全性,更好地发挥其作用
(3)炸药属于易爆物,生活中我们有时会接触一些易爆物,下列建议正确的是 .
a.在加油加气站禁止打电话 b.夜晚发现家中燃气泄漏需要开灯检查.
某学习小组运用传感器探究钠与水的反应得到如图图象,其中图1是反应过程中溶液温度与时间的图象,图2是反应过程中溶液pH与时间的图象。

回答下列问题:
(1)钠与水的反应属于 反应(填“吸热”或者“放热”)。
(2)反应产生的气体为氢气。检验氢气纯度的操作是(请补充完整):用拇指堵住集满气体的试管口, 。实验中能表明氢气不纯的现象是 。
(3)钠与水反应的化学方程式为 。
(4)将少量金属钠投入稀的氯化铁溶液中,产生了无色气体和一种红褐色沉淀,红褐色沉淀的化学式为 ;与反应前溶液相比,反应后溶液质量 (填“增大”、“不变”或者“减小”)。