在催化剂并加热的条件下,氨气和氧气能发生化学反应,其反应的化学方程式为4NH 3+5O 2  4X+6H 2O,则X的化学式是( )
4X+6H 2O,则X的化学式是( )
| A. |
N 2 |
B. |
N 2O |
C. |
NO |
D. |
NO 2 |
有一工业过程:

按要求回答下列问题:
(1)请将电石与水反应的化学方程式补充完整:
CaC 2+2H 2O═Ca(OH) 2+ ↑.
(2)有关物质常温下的溶解度如表:
| 物质 |
Ca(ClO 3) 2 |
CaCl 2 |
KClO 3 |
KCl |
| 溶解度/g |
209.0 |
74.5 |
7.3 |
34.2 |
上述流程中加入了KCl粉末,KCl与 (填化学式)发生了复分解反应得KClO 3晶体,该过程得到KClO 3晶体的原因是 .
(3)写出向CaCl 2溶液中通入两种气体生成CaCO 3的化学方程式: .
"冰毒"是毒性极强的毒品之一,其化学式为C 10H 15N,下列有关冰毒解释错误的是( )
| A. |
冰毒是由碳、氢、氮三种元素组成的化合物 |
B. |
冰毒是一种有机物,完全燃烧只生成CO 2和H 2O |
| C. |
冰毒中氮原子的原子结构示意图为 |
D. |
冰毒中碳、氢两种元素质量比为24:3 |
某纯净物X在空气中完全燃烧,反应的化学方程式为:X+2O 2  CO 2+2H 2O,下列关于X的说法正确的是( )
CO 2+2H 2O,下列关于X的说法正确的是( )
| A. |
X由碳、氢、氧三种元素组成 |
B. |
X的相对分子质量为10 |
| C. |
X中碳、氢元素的质量比为1:4 |
D. |
X属于有机化合物 |
2018年5月30日,媒体公布我国新疆准噶尔盆地探明一储量为10亿吨的大型油田。石油是工业的"血液",是多种碳氢化合物的混合物。
(1)石油不直接作为燃料的原因是 。
(2)石油在综合利用时,可以得到多种产品,如石油液化气(主要成分丁烷)、汽油等。丁烷燃烧的化学方程式为:2R+13O 2 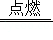 8CO 2+10H 2O,则丁烷(R)的化学式是 。
8CO 2+10H 2O,则丁烷(R)的化学式是 。
(3)化石能源是有限的,用一点少一点,最终会被耗尽,这充分说明了化石能源具有____ 性。
下列图象能正确反映其对应变化关系的是( )
| A. |
|
B. |
|
| C. |
|
D. |
|
现将10克A和足量B混合加热,A和B发生化学反应,10克A完全反应后生成6克C和8克D,则参加反应的A与B的质量比是( )
| A. |
3:4 |
B. |
2:3 |
C. |
5:2 |
D. |
5:3 |
硝酸是一种强氧化性酸,不仅能与活泼的金属反应,也能与许多不活泼的金属反应。如:3Cu+8HNO 3(稀)═3Cu(NO 3) 2+2X↑+4H 2O,则X的化学式为( )
| A. |
NO |
B. |
NO 2 |
C. |
N 2O |
D. |
N 2O 4 |
在反应2Cu(NO 3) 2  2CuO+4X↑+O 2↑中,X的化学式为( )
2CuO+4X↑+O 2↑中,X的化学式为( )
| A. |
N 2 |
B. |
NO 2 |
C. |
CO 2 |
D. |
NO |
学习化学知识后,观察物质世界就要从化学视角看。下列对打火机主要燃料丁烷 ( C 4H 10) 的看法不正确的是( )
| A. |
从组成上看:丁烷由碳、氢两种元素组成 |
| B. |
从结构上看:一个丁烷分子由4个碳原子、10个氢原子构成 |
| C. |
从性质上看:丁烷具有可燃性 |
| D. |
从变化上看:丁烷完全燃烧只生成水 |
在休渔期间,北海渔港停泊了大量的渔船,请回答下列问题:
(1)铁制渔船表面发生锈蚀,这是因为 。
(2)渔民用洗涤剂清洗机舱油污,这是利用洗涤剂的 功能。
请从元素组成的角度说明"水变柴油"不可能的原因是 。
(3)渔船上的木制品,为燃烧提供了 (填燃烧的条件之一)。
渔船上携带有干粉灭火器,干粉主要成分是NaHCO 3,受热后生成了Na 2CO 3、CO 2和一种氧化物,请写该反应的化学方程式 。
在一密闭容器中,a、b、c、d四种物质在一定条件下发生化学反应,反应前后各物质质量变化如图,下列说法错误的是( )

| A. |
该反应是分解反应 |
B. |
b可能是催化剂 |
| C. |
反应前后物质的总质量保持不变 |
D. |
反应生成的c和d质量相等 |
煤油中含有噻吩,噻吩(用X表示)有令人不愉快的气味,其燃烧的化学方程式可表示为:X+6O 2  4CO 2+SO 2+2H 2O,则噻吩X的化学式为( )
4CO 2+SO 2+2H 2O,则噻吩X的化学式为( )
| A. |
C 4H 4S 2 |
B. |
C 2H 6S |
C. |
C 4H 4S |
D. |
C 6H 6S |
如图图示是初中化学中常见实验:
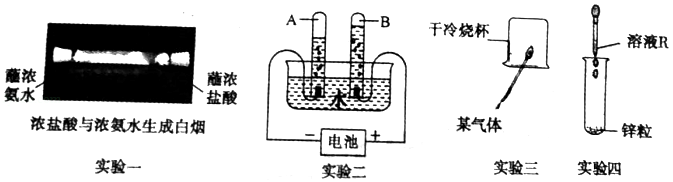
(1)实验一说明氯化氢分子和氨分子都在 ;形成白烟的化学方程式为 。
(2)实验二中试管A和试管B产生气体的体积比约为 ;试管 中产生的气体能用带有火星的木条进行检验。
(3)实验三中烧杯内壁有水雾出现,将烧杯正立后,加入澄清的石灰水振荡,澄清石灰水变浑浊,由此推断该气体的组成中一定含有 元素。
(4)实验四中若R溶液为稀盐酸,则观察到的现象是 ;若R溶液为氯化铜溶液,则反应的化学方程式为 。
以黄铁矿(主要成分为FeS 2)为原料生产硫酸的工艺流程如图所示:
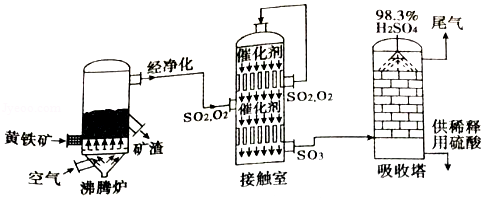
(1)沸腾炉中发生反应的化学方程式为:4FeS 2+11O 2 2X+8SO 2,其中X的化学式为 。
(2)接触室中发生反应的化学方程式为:2SO 2+O 2 2SO 3,产物SO 3中硫元素的化合价为 ;吸收塔中发生反应的化学方程式为:SO 3+H 2O═H 2SO 4,该反应的基本类型是 。若有800kg三氧化硫进入吸收塔中,且完全被吸收,则理论上制得硫酸的质量为 kg。
(3)O 2、SO 2、SO 3、H 2SO 4四种物质中属于氧化物的是 。
(4)实验室中稀释浓硫酸的操作是 。