为测定一瓶氢氧化钠溶液的质量分数,小张同学进行了以下实验:
如图1所示,在烧杯中加入5g氢氧化钠溶液,滴入几滴酚酞溶液,用滴管慢慢滴入1% 的稀盐酸,并不断搅拌,至溶液颜色恰好变为无色为止。
请回答:
(1)酚酞溶液的作用是 。
(2)当溶液颜色恰好变为无色时,共用去稀盐酸7.3g,则该氢氧化钠溶液中溶质的质量分数为 。
(3)在以上实验操作中,如继续滴加1%稀盐酸,并不断搅拌,则整个实验过程中溶液pH的变化曲线如图2所示。
①a点表示的含义是 ;
②b点溶液中含有的阳离子有 (填离子符号)。
(4)下图是盐酸滴入氢氧化钠溶液中有关粒子之间反应的示意图。由此可看出,盐酸与氢氧化钠能发生反应的原因是 。
氢氧化钠(NaOH)和氢氧化钙[Ca(OH)2]是常见的碱,在现实生活中有广泛的用途。根据所学知识回答:
(1)将氢氧化钠和氢氧化钙暴露在空气中都会变质生成某一类盐,该类盐的阴离子符号是 。
(2)实验室常用澄清的石灰水来检验二氧化碳,将饱和的石灰水溶液升高温度,溶液浓度将 (填“增大”、“减小”或“不变”)。
(3)长期不合理使用化肥(例如使用硫酸铵)会使土壤酸化(含有硫酸),熟石灰常用来改良酸性土壤,反应的化学方程式是 。
(4)农业生产中常用氢氧化钙和硫酸铜配置波尔多液来防治果树的霉叶病等,配制波尔多液时 (填“能”或“不能”)用铁制容器。
(5)氢氧化钠常用来干燥某些气体,其干燥原理是 。
从HCI、NaCl、NaOH、Na2CO3、Ca(OH)2几种溶液中取出其中的两种混合。
(1)若混合后溶液质量减小,可能的组合是________________。
(2)若混合的溶液质量不变,但发生了化学反应,有关的化学方程式为:________________、________________。
(3)将稀硫酸逐滴滴入剩下的几种组合中,若产生气体与加入稀硫酸有如图所示的关系,则这样的组合可能是________________。
(1)向盛有氢氧化钠溶液的锥形瓶里滴入几滴酚酞溶液,溶液变成色,
7(填">"、"<"或"="),逐滴向锥形瓶中滴人盐酸并振荡,观察到的现象是,溶液的
(填"增大"或"减小")。
(2)有一瓶溶液
是4.5,如果要使溶液的
升高,可以用的方法。
现有下图所示实验装置,请回答下列问题
(1)图中f仪器的名称:f 。
(2)用氯酸钾和二氧化锰固体制氧气,选用的发生装置是 (填装置序号),反应的化学方程式是 。在固定试管时,若发现试管口没有略向下倾斜,应调整铁夹 (填“A”、“B”或“C”)部位。若用装置④收集氧气,氧气应从导管口 (填“g”或“h”)端通入。
(3)实验室常用装置③代替装置②制取气体,该装置的优点是通过开关活塞来控制反应的开始和停止,
下列反应适用于该装置的是 (填序号)。
①大理石和稀盐酸
②过氧化氢溶液与硫酸铜固体
③锌粒与稀硫酸
(4)查阅资料:酸碱中和反应存在着放热现象。下图是探究中和反应中的能量变化的装置。
①调节U形管左右两端的液面高度一致后,打开分液漏斗的活塞滴下盐酸,观察到 现象,说明中和反应放出热量。
②与不装橡胶管相比,该装置更具说服力,理由是 。
酸碱中和反应在日常生活和工农业生产中有广泛的应用。请回答以下有关中和反应的问题。
(1)下左图象表示盐酸和氢氧化钠溶液发生反应过程中溶液的pH变化。进行该反应的实验操作是按照以上 (填甲或乙)图所示进行的,曲线上M点表示 。
(2)下图是NaOH溶液与稀盐酸恰好完全反应的微观示意图,由此图可以获得一些有价值的结论:①中和反应的实质是 。
②反应前后各元素的化合价 。(填“改变”或“没有改变”)
③ 和 离子实质上没有参加反应。
(3)根据乙图进行的实验中,用温度计测出烧杯中溶液的温度变化如图所示:
①由图知,稀盐酸与氢氧化钠溶液发生的反应是 (填“放热”或“吸热”)反应。
②恰好中和时溶液温度达到 。
关于硫酸的性质实验
① 下图是某同学组建的实验室稀硫酸与锌混合制取氢气的装置。
 |
回答:a仪器的名称是 ;装置中用于添加液体的仪器名称是 ;装置中出现 处错误。若按照上述装置制取氢气会造成的后果是 。
②稀硫酸与含少量氧化铁的铁粉反应实验:下图是反应的实验过程。(装置气密性良好)

写出铁与硫酸反应的化学方程式 。以上U型管中红墨水变化情况符合该实验的是 。(填写序号)
③ 中和反应实验:氢氧化钠与硫酸反应无明显现象。为了证明氢氧化钠与硫酸确实发生了化学反应,进行了如下实验:
取2mLNaOH溶液于试管中,滴入1~2滴酚酞试剂,振荡。然后,逐滴加入稀硫酸,同时不断振荡试管,整个实验过程的现象是 。由此证明,上述实验过程确实发生了化学反应。反应的化学方程式是 。
“物质的组成与结构决定物质的性质”是化学科学中的重要观点。按照这一观点讨论下面的问题。 酸溶液具有一些共同的化学性质,是因为酸溶液中都含有的离子是 ;碱溶液也具有一些共同的化学性质,是因为碱溶液中都含有的离子是 。
写出下图所示的反应方程式 , 该反应前后,溶液中减少的离子是 。

100g20%的氢氧化钠溶液中含有氢氧化钠的质量是 g,与足量的稀盐酸反应,生成氯化钠的质量是 g。
胃酸过多须服用抗酸药。下表为两种抗酸药的有效成分及其构成微粒:
| 抗胃酸药 |
复方氢氧化镁片 |
铝碳酸镁片 |
| 有效成分 |
Mg(OH)2 |
AlMg(OH)3CO3 |
| 构成微粒 |
Mg2+、OH- |
Al3+、Mg2+、OH-、CO32- |
由于抗酸药有效成分不同,起抗酸作用(即消耗胃液中盐酸)的微粒也有差异。
(1)Mg(OH)2起抗酸作用的微粒是 (填微粒符号,下同)。
(2)铝碳酸镁与盐酸反应生成两种盐和另外两种常见化合物。请写出相关化学方程式 。
(6分)归纳总结对比分析是学习化学常用的科学方法,如图所示:两圆重迭的区域表示它们的共同特征(相似点),重迭区域以外的部分表示它们的独有特征(不同点)
(1)观察A图,从组成角度写出与上图区域①相对应的适当内容
。(填一点)
(2)观察B图,写出符合②的酸的化学性质
、 .(填两点)还可看出酸和碱都能与某些盐发生反应,请你写出既能与盐酸反应,又能与熟石灰发生化学反应一种盐的化学式为 。
(3)观察C图,从物质分类上写出符合④⑤的物质的化学式 、 。
某化工厂排出的废水透明、澄清、略显蓝色。一同学取少量废水,加入过量的盐酸,有不溶于稀HNO3的白色沉淀生成。过滤,将所得滤液分成两份,一份滤液中加入少量稀H2SO4,也有不溶于稀HNO3的白色沉淀生成;另一份滤液中加入过量NaOH溶液,产生蓝色沉淀。试回答:
(1)用化学式回答:废水中加入过量的盐酸后,生成的白色沉淀是________________。
滤液中加入过量NaOH溶液后,生成的蓝色沉淀是_________________________。
(2)废水中一定含有的物质是__________________(填编号):
| A.氯化物 | B.硝酸盐 | C.硫酸盐 | D.碳酸盐 |
请简述你做出选择的理由__________________________________。
将稀盐酸慢慢滴入盛有氢氧化钠溶液的烧杯中,用温度计测量烧杯中溶液的温度,温度随加入稀盐酸的质量变化曲线如图所示。
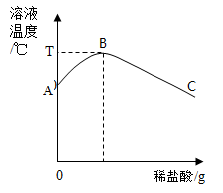
(1)在滴加的过程中,烧杯中溶液的
逐渐(填"增大"、"减小"或"不变")。
(2)由图可知,稀盐酸与氢氧化钠溶液发生的反应是(填"放热"或"吸热")反应。
(3)图中
点时,溶液中的溶质是(填化学式)。
氧化镁在医药、建筑等行业应用广泛.硫酸镁还原热解制备高纯氧化镁是一种新的探索.以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
(1)MgCO3与稀硫酸反应的化学方程式为 ;
(2)加入H2O2氧化时,发生反应的化学方程式为(已经配平,X属于常见的化合物): ,则X的化学式为 ;
,则X的化学式为 ;
(3)NH3·H2O是氨水的主要成分,溶液显 性,加入氨水时,溶液的PH值 (填“增大”、“减少”或“不变”),当PH≈4时,会产生红褐色沉淀,则滤渣2 的成分是 (填化学式)。
(4)通常用PH试纸测定溶液的PH值,其操作方法是 。
(5)煅烧过程存在以下反应:木炭和硫酸镁在高温下除得到氧化镁外,还得两种气体,一种会造成酸雨,另一种大量排放则会引起温室效应。请写出该反应的化学方程式: 。
(6分)水是最普通、最常见的物质之一。
(1)电解水可证明水由氢、氧两种元素组成,该反应的化学方程式为 。
(2)水是重要的溶剂和化工原料。氯碱工业以饱和食盐水为原料获得烧碱等化工产品,反应原理为:
2NaCl+2H2O 2NaOH+Cl2↑+H2↑。
2NaOH+Cl2↑+H2↑。
①20℃时,NaCl的溶解度为36g。则该温度下,饱和食盐水中溶质与溶剂的质量比为 ;
②烧碱可用于处理硫酸泄漏,反应的化学方程式为 。
(3)水在化学实验中具有重要作用。将铁丝放在潮湿的空气中(如图所示),一段时间后,观察到导管内液面上升,打开K,一段时间后导管口有气泡冒出。请分别解释导管内液面上升和下降的原因: 。
盐酸与氢氧化钠溶液发生反应过程中溶液的pH变化如图一,请分析并回答问题: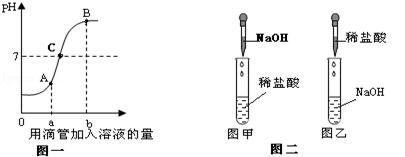
(1)由图一可判断,该反应的实验过程是按照图二中的 (填“图甲”或“图乙”)来进行的。
(2)图一中A、B、C三点表示的溶液,两种反应物恰好完全反应的点是 点,加入紫色石蕊试液会呈现红色的是 点的溶液,此时溶液中的含有的阳离子是 。
(3)加了探究盐酸与氢氧化钠溶液反应后的生成物,小军的实验过程如下:
实验过程:先按图甲操作,振荡后加入硝酸银溶液。观察现象:出现白色沉淀。得出结论:证明生成了氯化钠。小明认为这个结论不正确,合理的解释是 。