某化工厂化验室用10%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液40g,洗涤后的溶液呈中性。这一定量石油产品中含H2SO4质量是多少?
化学实验课上,老师为每组同学分别提供了一瓶氢氧化钠溶液,让他们用1%的稀盐酸(密度为1.1g/mL)来测定其溶质的质量分数。甲组同学的实验如图1所示:在烧杯中加入5g氢氧化钠溶液,滴入几滴酚酞溶液,用滴管慢慢滴入1%的稀盐酸,并不断搅拌,溶液pH的变化如图2所示.请回答
(1)a点溶液中大量存在的离子有__________
(2)b点溶液中的溶质有__________________
(3)计算氢氧化钠溶液中溶质的质量分数。(保留一位小数)
实验室中有一瓶标签被腐蚀的盐酸,小明为了测定该盐酸的溶质质量分数,取5g 8%的氢氧化钠溶液,先滴加2滴酚酞溶液,再加该盐酸,边滴边振荡,至溶液恰好变成无色为止,共消耗了5g该盐酸。请计算该盐酸的溶质质量分数。
某环保部门对某工厂的废水进行分析,结果表明:废水中含有少量硫酸。取一定量的废水用2%的氢氧化钠溶液中和(已知废水中的其他成分不与氢氧化钠反应),至pH等于7时,消耗氢氧化钠溶液的质量为40g,同时测得反应后溶液的质量为138 g。试计算该工厂排放的废水中硫酸的质量分数。
在一定量的氢氧化钠稀溶液中逐渐滴加溶质质量分数为0.73%的稀盐酸,反应过程中不断搅拌并及时测量不同时刻溶液的温度与pH,记录数据如下表:
| 反应时间(秒) |
0 |
25 |
50 |
75 |
100 |
125 |
150 |
175 |
200 |
| 滴入稀盐酸体积(毫升) |
0 |
4 |
8 |
12 |
16 |
20 |
24 |
28 |
32 |
| pH |
13.2 |
13.0 |
12.7 |
12.4 |
12.1 |
7.0 |
2.0 |
1.6 |
1.3 |
| 温度(℃) |
36.9 |
37.5 |
38.0 |
38.5 |
38.8 |
39.2 |
39.0 |
38.8 |
38.6 |
(1)观察上表发现,当反应时间在 秒时,氢氧化钠与盐酸恰好中和。
(2)完成上述实验,能否用氢氧化钠固体代替请说明原因 。
(3)结合上表中滴入稀盐酸体积与pH的变化数据,试计算氢氧化钠稀溶液中溶质的质量。(稀盐酸的密度取l.0克/毫升;化学方程式为:NaOH+HCl=NaCl+H2O)
以下是甲、乙两同学对有关镁与盐酸反应的系列研究。
研究一:镁与盐酸反应过程中的能量变化以及反应速率的变化:
(1)反应中试管外壁发烫,说明镁与稀盐酸反应是 反应(填
“吸热”或“放热”)。
(2)实验测得镁片产生气体的速率(v)与时间(t)的关系如图所示,
则t1~t2时间内反应速率逐渐加快的主要原因是 。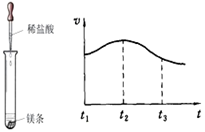
研究二:反应后所得溶液的酸碱性探究:
(3)甲同学反应后用pH试纸测定试管中溶液的酸碱性,发现pH小于7,说明甲同学所得溶
液呈 性(选填“酸”“碱”或“中”)。
甲同学:猜想Ⅰ:稀盐酸过量,使溶液pH小于7;猜想Ⅱ:氯化镁溶液pH小于7。为
验证猜想,甲同学需测定 溶液的酸碱性,实验表明该溶液显弱酸性。
(4)乙同学重复甲同学实验时,发现反应后所得试管中溶液pH大于7。发现实验与甲同学实
验不同的是,反应后的试管中镁条有剩余。乙同学猜想可能是镁与热水反应生成了碱性
物质。乙同学为验证猜想,在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶
液很快变为红色,同时还观察到镁条表面有气体生成,收集并点燃该气体,发现能燃烧,
请根据实验现象写出镁与水反应的化学反应方程式 。
(5)金属氯化物溶液pH值大小与金属的活动性有关,如氯化钠溶液显中性,氯化镁溶液显弱酸性,则氯化钾溶液显 性。
(6)活泼金属能与水在一定条件下反应。实验发现钠与冷水剧烈反应,产生大量的气体。由
此可见金属与水反应与金属的活动性顺序 (填“有关”或“无关”)。
研究三:金属活动性强弱与原子结构的关系:
下图为镁原子、钙原子和钡原子结构示意图。已知其中Ba的活动性最强,据此推测,金属的活动性除与原子的最外层电子数有关,还与 有关。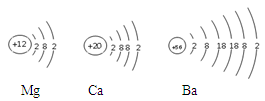
研究四:确定镁条的成分:
称取3.2g表面被氧化的镁条, 放入100g稀盐酸中恰好完全反应,生成气体0.2g。求:
(7)此镁条中金属镁的质量。(写出计算过程,共3分)
(8)反应后所得溶液中溶质的质量分数 。(计算结果保留一位小数)
在盛有40g溶质质量分数为20%氢氧化钠溶液的烧杯中,用滴管吸取盐酸逐滴加入盛有氢氧化钠溶液的烧杯中,验证“中和反应会放热”,同时用pH计记录溶液pH的变化,绘制成以下函数图像。
⑴ 用玻璃棒蘸取X点溶液,在酒精灯火焰上加热至蒸干,玻璃棒上留下的固体中一定含有 。(填化学式)
⑵ 为什么不能用氢氧化钠固体和稀盐酸反应验证“中和反应会放热”。
。
⑶ 当pH=7时,求溶液中溶质的质量分数。
为测定标有质量分数为32%的盐酸的实际质量分数,小明实验时先在烧杯中加入20g40%的氢氧化钠溶液,再逐滴加入该盐酸,测定出加入盐酸的质量与烧杯中溶液pH的关系如图。
(1)所用氢氧化钠溶液中溶质的质量为____________g。
(2)请认真看清右图信息后回答以下问题
①当滴加盐酸到C点时,所消耗的盐酸中溶质的质量是多少?
②该盐酸的实际质量分数是多少?(保留到0.1%)
③导致盐酸溶液溶质质量分数改变的原因是: 。
④当滴加盐酸到图像中D点时,烧杯中溶液的溶质是 。(填化学式)
为测定某稀盐酸溶液溶质的质量分数,取100g该溶液于烧杯中,向烧杯中滴入16%的NaOH溶液,用pH计测得滴入NaOH溶液质量与pH的关系如右图所示。
(1)在a点时,烧杯中溶液的溶质是 ,此时向溶液中滴入紫色石蕊试液,溶液呈 色。
(2)通过计算求盐酸溶液溶质的质量分数。
(3)若改用16%的氢氧化钾溶液来测定盐酸溶质的质量分数,当滴入KOH溶液的质量为100g时,溶液的pH 7(填“大于”、“小于”或“等于”)。
化学兴趣小组的同学在实验室测定某赤铁矿石中氧化铁的质量分数。取赤铁矿石样品10.0 g,加入稀盐酸109.5 g,恰好完全反应。过滤得到滤渣2.0 g(假设杂质既不溶于水也不与酸发生反应)。请计算:
(1)赤铁矿石中氧化铁的质量分数;
(2)反应后所得溶液中溶质的质量分数。
(计算结果精确到0.1%,写出必要的计算过程。可能用到得相对原子质量:H—1,C—12,O—16,Cl—35.5, Fe—56)