根据右表判断,肉类变质过程中酸碱性的变化趋势是
| A.酸性变弱 | B.碱性变弱 |
| C.酸性变强 | D.酸性不变 |
小刚测定了下列4种日用品的pH,其中呈酸性的是()
| 日用品 |
A.洁厕灵 |
B.洗涤灵 |
C.洗发水 |
D.消毒液 |
| pH |
1 |
7 |
9 |
12 |
正常人的体液 都在一个相对稳定的范围内,否则人会生病。下列人体体液中,酸性最强的是
| A. | 唾液( : ) | B. | 血液( : ) |
| C. | 胆汁( : ) | D. | 胃酸( : ) |
下列数据是常见物质的 范围,其中酸性最强的是()
| A. | 瓶装饮用水 ( ) | B. | 番茄汁( ) |
| C. | 柠檬汁( ) | D. | 液体肥皂( ) |
化学兴趣小组的同学在实验室测定某赤铁矿石中氧化铁的质量分数。取赤铁矿石样品10.0 g,加入稀盐酸109.5 g,恰好完全反应。过滤得到滤渣2.0 g(假设杂质既不溶于水也不与酸发生反应)。请计算:
(1)赤铁矿石中氧化铁的质量分数;
(2)反应后所得溶液中溶质的质量分数。
(计算结果精确到0.1%,写出必要的计算过程。可能用到得相对原子质量:H—1,C—12,O—16,Cl—35.5, Fe—56)
某化工厂生产的纯碱中含有少量的氯化钠。化学活动小组的同学合理利用下列装置对此样品进行分析。根据进入量筒中液体的体积来计算该样品中纯碱的含量。已知二氧化碳在饱和碳酸氢钠溶液中溶解度极小。
请你与活动小组的同学一起思考并回答下列问题:
(1)进行实验时,应选择上述装置中的 组合更合理(选填甲、乙、丙、丁)。所选装置各导管的连接顺序从左到右依次为 (填导管序号)。
(2)反应开始后,甲中有气泡产生,该反应的化学方程式为 。
(3)若甲中采用盐酸进行实验,测得数据与用稀硫酸时不一致,则采用稀盐酸时测得样品中纯碱的质量分数 (填较大、较小)。
(4)实验中,若样品取量过多,可能导致反应液体外溢,造成实验误差;若样品取量太少,会导致 ,也会造成实验误差。
世界万物都是由各种元素组成的,用好化学用语,对日后化学的学习是非常有帮助的。请在氧、硫、氢、镁这4种元素中选择适当的元素组成物质,写出符合下列要求的化学式、化学反应方程式(每空只要求写一个):
| 物质类别 |
酸 |
碱 |
盐 |
金属氧化物 |
非金属氧化物 |
| 化学式 |
|
|
|
|
|
置换反应 :
中和反应:
酸和氧化物反应:
在做酸和碱中和反应的实验时,有时需借助指示剂颜色的变化判断反应是否发生、完成。向含有酚酞的NaOH溶液的烧杯中,不断滴入稀盐酸。此过程烧杯中溶液颜色的变化是
| A.由红色变为蓝色 | B.由蓝色变为红色 |
| C.由红色变为无色 | D.由无色变成红色 |
在氢氧化钠溶液中加入盐酸,至恰好完全反应,反应的微观示意图见下图。下列有关认识错误的是( )
| A.反应结束时溶液的pH="7" |
| B.反应前后元素的种类没有变化 |
| C.酸与碱的反应属于复分解反应 |
| D.该微观图还可说明所有物质都是由分子构成的 |
下列各组物质之间的反应,能借助无色酚酞溶液判断出反应发生的是
| A.镁和稀盐酸 | B.氢氧化钙溶液和稀盐酸 |
| C.铝和硫酸铜溶液 | D.碳酸钡和稀盐酸 |
在高效复习课堂中,同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾” 四种物质的溶液对 “复分解反应发生的条件”进行再探究。
【知识回放】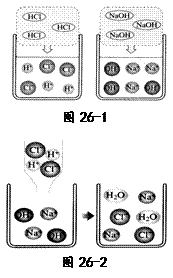
通过判断上述四种溶液两两之间能否发生反应,我能写出其中符合下列条件的两个化学方程式:
⑴一个中和反应 ;
⑵一个有沉淀生成的反应 。
【挖掘实质】
⑴图26-1是HCl和NaOH在水中解离出离子的示意图,小丽发现HCl在水中会解离出H+和Cl-,NaOH在水中会解离出Na+和OH-,以此类推硝酸钡在水中会解离出的离子是 (填离子符号)。
⑵图26-2是稀盐酸和氢氧化钠溶液发生化学反应的微观过程示意图,该化学反应的实质可以表示为
H+ + OH- = H2O
我也能用同样的方式表示上述四种溶液两两之间发生反应时有气体生成的反应的实质 。
【实践运用】
⑴通过上述探究发现,在溶液中H+和OH-不能大量共存,我还发现在溶液中
和 (填离子符号,下同)也不能大量共存。
⑵利用上述四种物质的溶液完成实验后,将所得物质混合并过滤,得到一种无色溶液。经测定,该溶液显酸性。则在该溶液中一定含有的离子是 。为了验证该溶液中可能含有的离子是否存在,我设计如下实验进行验证。
| 溶液中可能含有的离子 |
设计实验验证(实验步骤、现象及对应的结论) |
| |
|
【知识升华】
对“复分解反应发生的条件”的再探究,我发现在分析多种溶液混合后所得溶液中离子的成分时,应考虑的因素是 。
将下列各组物质混合后溶于水,得到无色溶液的是()
| A. | 、 、 | B. | 、 、 |
| C. | 、 、 | D. | 、 、 |