铜制器物在潮湿环境中表面会产生绿色的锈迹,俗称铜绿。某化学学习小组对铜绿成分产生了浓厚兴趣。
【提出问题】铜绿中除铜元素外还有其它什么元素?
【查阅资料】①无水硫酸铜遇水变蓝色;
②碳与一般的酸不反应;
③CuO+H2SO4(稀)=CuSO4+H2O。
【实验探究】该小组同学找到了一些铜绿粉末并进行了如下实验:
【观察分析】A装置中绿色粉末变为黑色;
B装置中无水硫酸铜变为蓝色;
C装置中澄清石灰水变浑浊,该反应的化学方程式为 。
【实验结论】铜绿中除铜元素外还有 、 和碳等元素。
【交流讨论】根据铜绿的组成,小组同学对A装置中产生的黑色粉末的成分有如下两种不同的猜想:
(1)全部为CuO (2)CuO和C的混合物
【深入探究】
| 实验步骤 |
实验现象 |
实验结论 |
| ①取少量黑色粉末于试管中,滴加足量的稀硫酸 |
① |
猜想(1)正确 |
| ②①取少量黑色粉末于试管中,滴加足量的稀硫酸 |
② |
猜想(2)正确 |
【实验结论】化学学习小组同学通过实验证明猜想(1)正确。
【反思应用】根据铜绿中所含元素,可知铜生锈不仅与空气中的氧气、水有关,还可能与空气中的 等有关;要保护博物馆里的青铜器,减缓生锈,我们可以减少青铜器与 接触。
(1)探究影响锌与稀硫酸反应快慢的因素。反应过程中,用前10min内收集的氢气体积比较反应的快慢。控制其他条件相同,进行下表四组实验,获得数据如下表。
| 实验编号 |
试剂 |
前10 min 内产生的氢气体积(mL) |
|
| 不同纯度的锌 |
不同体积和浓度的稀硫酸 |
||
| a |
纯锌 |
30 mL 30 % |
564.3 |
| b |
含杂质的锌 |
30 mL 30 % |
634.7 |
| c |
纯锌 |
30 mL 20 % |
449.3 |
| d |
纯锌 |
40 mL 30 % |
602.8 |
①比较实验a和实验b,可以得到的结论是 。
②为了研究硫酸浓度对反应快慢的影响,需比较实验 和实验 (填编号)。
③控制其他条件相同,需控制的条件是 (例举一种条件即可)。
(2)利用锌皮和稀硫酸制取氢气,并测定锌皮中锌的质量分数
制取氢气的实验操作有:
a.收集气体;
b.向锥形瓶里装锌皮;
c.连接仪器,检查装置气密性;
d.向长颈漏斗中注入稀硫酸;
e.装配仪器。
正确的操作顺序为 。
(3)测定锌皮中锌的质量分数:已知该锌皮中含有少量杂质铁,将该锌皮放入如下图所示的盛有稀硫酸的锥形瓶中,多次实验后,取平均值所得数据如下表:
| 反应前 |
充分反应后装置及反应剩余物质质量 |
|
| 装置和足量的稀硫酸质量 |
锌皮质量 |
|
| 342.2g |
15.8g |
357.5g |
(9分)某化学实验小组同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时有较多的气泡放出。生成的是什么气体呢?同学们决定进行探究。探究前老师提示,该反应生成的气体只有一种,硫酸铜溶液中可能混有硫酸。
【提出猜想】
①生成的气体可能是SO2或O2或H2。
【查阅资料】
①SO2与二氧化碳化学性质相似,如它也能使澄清石灰水变浑浊。
②浓硫酸具有强烈的吸水性,可做气体的干燥剂。
③H2与CO均可以还原金属氧化物。
【方案设计】甲同学设计了如下实验方案,验证猜想的气体。
甲同学认为:若观察到 ,则气体为SO2。
若观察到 ,则气体为O2。
【实验探究】
①实验开始时,应先将收集到的气体从a处通入一段时间后,再点燃 C 处酒精灯。
这样操作的目的是 。
②实验过程中发现 A 装置中溶液不变浑浊, C 装置中表面含CuO的铜网由黑色变为光亮的红色,试管壁上有水滴生成;
【实验结论】①生成的气体是 。
②铁放入该硫酸铜溶液中所发生反应的化学方程式为 。
【实验反思】
乙同学认为甲同学的实验方案操作复杂,他只需一盒火柴即可确定该气体成分。你认为乙同学的实验方案是 。
(15分)人类的生活和生产都离不开金属材料。
(1)铁是目前年产量最高的金属。
①高炉炼铁时需要的主要原料有铁矿石、焦炭、_______等。
②炼铁的反应原理主要是利用CO把铁从铁矿石中______出来(填“置换”或“还原”),表示该原理的化学方程式是__ _ _。
③下列说法正确的是__________________。(填字母序号)
| A.铁生锈就是铁与空气中的氧气发生的化学反应 |
| B.回收废旧金属有利于节约金属资源 |
| C.铁丝在氧气中剧烈燃烧,火星四射,生成氧化铁 |
| D.在铁桶中加入硫酸铜溶液和石灰乳来配制农药波尔多液 |
(2)请你参与探究几种常见金属饰品所含金属的相关活动,并回答下列问题。
【提出问题】Ⅰ.怎样鉴别真假黄金?Ⅱ.怎样确定钯的金属活动性?
【查阅资料】假黄金通常是黄铜(Cu﹣Zn合金);
钯(Pd)呈银白色,有金属光泽,可用作饰品
【实验药品】钯(Pd)、铂(Pt)、稀盐酸、硝酸银溶液和氯化钯(PdCl2)溶液
【实验探究】
①鉴别黄金样品的真假:取黄金样品于试管中,滴加稀盐酸后,观察样品表面有气泡产生,说明此样品为 (填“真”或“假”)黄金,其中发生的反应方程式为________。
②探究钯的金属活动性:依据生活经验,同学们猜测钯的活动性可能与银和铂相近,于是他们利用上述药品进行如下实验:
| 实验步骤 |
实验现象 |
实验结论 |
| 把钯浸入硝酸银溶液中 |
无明显现象 |
钯的活动性比银 。(填“强”或“弱”) |
| 把铂浸入氯化钯溶液中 |
_________ |
钯的活动性比铂强。 |
初步得出结论:钯、银、铂的金属活动性由强到弱的顺序为____ 。
(3)现用一定量的AgNO3和Cu(NO3)2混合溶液,进行了如图所示的实验,并对溶液A和固体B的成分进行了分析和研究。
【提出问题】溶液A中的溶质可能有哪些?
【作出猜想】
①只有Zn(NO)3
②有Zn(NO3)2、AgNO3
③有Zn(NO3)2、Cu(NO3)2
④有Zn(NO3)2、Cu(NO3)2、AgNO3
【交流讨论】不合理的猜想是__ _____(填标号),其理由是____ ___。
【实验探究】根据下表中的实验步骤及现象,完成表中的实验结论
| 实验步骤 |
现象 |
实验结论 |
| 取少量固体B,滴加稀盐酸 |
有气泡产生 |
溶液A中的溶质成分符合猜想 _, 固体B中的金属成分有 _种。 |
化学实验室要从X、银、铜、锌四种金属混合物中分离某贵重金属。流程如下:
请回答:
(1)四种金属的活动性顺序由强到弱的是 ;
(2)写出步骤②中产生气体的化学方程式 ;
(3)写出步骤③中的反应现象 ;
(4)滤液C中一定含有的溶质是 可能含有的溶质是 ;
某同学在电视寻宝节目中,看到一些铜制文物上有绿色的锈迹,并对绿色锈迹产生了探究兴趣。
【查阅资料】
①绿色锈迹是碱式碳酸铜[Cu2(OH)2CO3],受热易分解。
②无水硫酸铜为白色粉末,遇水变蓝。
③碱石灰是CaO和NaOH的固体混合物,NaOH与CO2反应生成碳酸钠固体和水。
④氧化铜与稀硫酸反应生成蓝色溶液,碳粉不与稀硫酸反应也不溶解在稀硫酸中。
【发现问题】
查阅资料后,该同学将少量碱式碳酸铜放入试管中加热,发现试管中的固体由绿色变成黑色,同时试管壁上有无色液滴生成。
为了进一步确定碱式碳酸铜受热分解的产物,进行了如下探究:
探究一:碱式碳酸铜受热分解生成的黑色固体的成分。
【猜想与假设】该黑色固体可能是①碳粉;② ;③碳和氧化铜的混合物。
【设计方案】请帮助该同学完成下述实验报告。
| 实验操作与现象 |
实验结论 |
| |
猜想②正确 |
探究二:碱式碳酸铜受热分解还会生成CO2和H2O。
【进行实验】选择如下图所示装置进行验证。
步骤一:连接A和B,打开活塞,通入一段时间的空气。
步骤二,关闭活塞,依次连接装置A→B→ → (填“C”、“D”)。
步骤三:点燃酒精灯,观察到明显现象后,停止加热。
【解释与结论】
①当观察到 ,说明碱式碳酸铜受热分解生成了CO2和 H2O,写出C中反应的化学方程式 。
②Cu2(OH)2CO3受热分解的化学方程式 。
【反思与评价】
上述装置中A的作用是 。
(本题7分)某校化学兴趣小组经查阅资料得知:铝是重要的轻金属,广泛应用于航空、电讯和建筑等领域。铝也有其特殊的性质:①铝的熔点是660℃,氧化铝的熔点高达2054℃。②铝虽比锌活泼,但是将铝和锌分别投入稀硫酸中,铝比锌反应慢得多。③尽管铝表面致密的氧化膜能使铝与其周围的介质(空气、水)隔绝,但“奇怪”的是铝制容器仍不能用来盛放和腌制咸菜。为此该小组进行了“铝表面氧化膜”的探究实验,其过程如下,请完成填空:
【实验1】用坩埚钳夹住一块擦去氧化膜的铝片,放在酒精灯火焰上灼烧,铝片表面接触火焰的部分变暗片刻后变软;轻轻摇动,会左右摇晃,却不像蜡烛那样滴落。
问题:
(1)请写出在空气中灼烧铝片的化学方程式 ;
(2)铝片接触火焰的部分不像蜡烛那样滴落的原因是 。
【实验2】取2条未用砂纸打磨过的铝片,一片浸入CuCl2稀溶液中,其表面很快析出较多红色粉末状固体;而另一片浸入CuSO4稀溶液中现象一直不明显。
问题:试猜测产生这种现象差异的因素是
【实验3】用砂纸打磨一铝片使其表面较粗糙,再将其放入CuSO4稀溶液中,直到2-3分钟后,铝片表面才有少量红色固体附着。
问题:试写出铝片表面附着红色固体的化学方程式: ;
【实验4】向实验2的CuSO4稀溶液中滴入3-5滴NaCl稀溶液,铝片表面逐渐有红色固体析出。
【实验5】向实验2的CuSO4稀溶液中滴入3-5滴Na2SO4稀溶液,铝片表面现象一直不明显。
问题:根据实验2、3、4、5的现象可以得出的结论是 。
(本题共9分)碱式碳酸铜又称铜绿,是铜与空气中的氧气、二氧化碳和水等物质反应产生的物质。某化学兴趣小组同学发现Cu2(OH)2CO3受热分解后除生成CO2和 H2O外,试管中还有一些黑色粉末状固体。请结合所学知识,回答下列问题:
(1)若要证明有CO2和H2O生成,应选择下图的装置是 (填字母序号);理由是 。
(2)探究黑色粉末的成分。
【猜想与假设】
该黑色粉末可能是①碳粉、②氧化铜、③ ;
小明同学经过认真分析,认为上述猜想 一定不正确(填序号);其理由是 ;
【查阅资料】
a.碳粉与氧化铜均为不溶于水的黑色粉末;
b.氧化铜能与稀盐酸反应形成蓝色溶液;
c.碳粉既不与稀盐酸反应也不溶解在稀盐酸中。
【实验验证】
请你帮小组同学完成下述实验报告。
| 实验步骤 |
实验现象 |
实验结论 |
| |
|
猜想②正确 |
(3)铜绿[Cu2 (OH)2CO3]受热分解的化学反应方程式: 。
(1)目前世界上一半以上的铜用于电力和电信工业,是因为铜具有 (填字母)
| A.导热性 | B.延展性 | C.导电性 | D.金属光泽 |
(2)我国第四套人民币的硬币从1999年开始发行,一元为钢芯镀镍(Ni),五角币为钢芯镀铜合金,一角币为铝合金或不锈钢。在选择铸造硬币的材料时需要考虑的因素是有 (填一条即可)。
①镍能与盐酸或稀硫酸反应,生成可溶于水的正二价镍的化合物,并放出氢气。其反应没有铁与酸反应剧烈。镍与盐酸反应的化学方程式为 .
②用镍片、硫酸亚铁溶液和 溶液做实验也能判断Ni 、Fe、Cu的金属活动性顺序。三种金属的活动性顺序为 。
(3)若将一定质量的Zn放入CuCl2和MgCl2的混合溶液中,充分反应后过滤,所得滤液中一定含有的溶质是 。
(4)活动课上小明将一枚五角币放在酒精灯火焰上加热片刻,发现表面变黑。
【假设与预测】假设I.五角币加热变黑,是因为酒精灯内焰的黑烟附着在五角币的镀铜上;
假设II.五角币加热变黑,是因为五角币上的镀铜与______发生了化学反应。
【实验与事实】
实验一:用洁净的干布擦一擦五角币上的黑色物质,黑色物质不易被擦去;再另 取一枚五角币放在石棉网上,用酒精灯加热片刻,五角币也变黑。
实验二:取一块铜片放入小试管中并塞上橡皮塞,然后用酒精灯加热直至试管中铜 片变黑;再将铜片反转到另一面,加热片刻,铜片不再变黑。
【解释与结论】上述实验一和实验二证实,假设 __ ___ 不成立。
【表达与交流】铜片在空气中加热,发生的化学反应方程式为___ ___ 。
同学们通过实验来验证Cu、Fe、Ag三种金属的活动性顺序。实验室提供的药品有:Cu(NO3)2溶液、AgNO3溶液、Fe(NO3)2溶液、稀盐酸、铜丝、铁丝、银丝。
(1)小华同学设计并完成了如下实验:
①把铁丝插入装有稀盐酸的试管中; ②把铜丝插入装有稀盐酸的试管中;
③把银丝插入装有稀盐酸的试管中; ④把铜丝插入装有AgNO3溶液的试管中。
观察到①中的实验现象是 ,④中的化学方程式是 。你认为小华所做的实验 (填序号)是多余的。
(2)后来,小贝只选用了上述药品中的三种,通过两步实验,也达到了实验目的。他选用的三种药品是 (写出一种药品组合即可)。
小贝还想探究Zn、Fe、Cu的活动性顺序,设计了如图的两个实验:小贝以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是 。
小明同学对“锌与硫酸反应快慢的影响因素”进行了探究。
【提出问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】
a.可能与硫酸的质量分数有关;
b.可能与锌的形状有关。
【查阅资料】
锌的化学性质比较活泼,在常温下的空气中,表面生成一层“保护膜”,可阻止进一步氧化。该“保护膜”可以和酸反应,但不产生氢气。
【设计并实验】小兵用不同质量分数的硫酸和不同形状的锌进行如下实验。
| 实验编号 |
硫酸的质量分数(均取20mL) |
锌的形状(均取1g) |
氢气的体积(mL)(均收集3分钟) |
| ① |
20% |
锌粒 |
31.7 |
| ② |
20% |
锌片 |
50.9 |
| ③ |
20% |
锌粒 |
61.7 |
| ④ |
30% |
锌片 |
79.9 |
(1)写出稀硫酸与锌反应的化学方程式______________________________。
(2)小兵用图装置收集并测量氢气的体积,其中量筒的作用是_______________________,氢气应从________(填e或f或g)管通入;
【收集证据】
(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是____________;
【得出结论】
(4)结论是_____________________________________________________;
【评价与反思】
(5)下表是小兵第①组实验的详细数据。
| 时段(均为1分钟) |
第1分钟 |
第2分钟 |
第3分钟 |
第4分钟 |
第5分钟 |
第6分钟 |
| H2的体积 |
3.1mL |
16.7mL |
11. 9mL |
9.6mL |
7.6mL |
6.0mL |
请描述锌与硫酸反应的先慢后快最后又变慢的原因___________________________;
(6)你认为锌与硫酸反应的快慢可能还受 因素影响?
(7)取某厂生产的生铁样品6g,与100g足量的稀硫酸充分反应后,称得剩余物质的总质量为105.8g。
①生成气体的质量为 克;
②该厂生产的生铁样品中铁的质量分数是多少?(写出具体的过程,结果精确到0.1%)
③该厂生产的生铁是否合格? (填“合格”或“不合格”)
小明同学学习了金属的化学性质后,想对“锌与硫酸反应快慢的影响因素”进行探究。
【提出问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】①可能与硫酸的质量分数有关
②可能与锌的形状有关
【设计并实验】小明用不同质量分数的硫酸和不同形状的锌进行如下实验。
| 实验编号 |
硫酸的质量分数 (均取20ml) |
锌的形状 (均取1g) |
氢气的体积(ml) (均收集3分钟) |
| ① |
20% |
锌粒 |
31.7 |
| ② |
20% |
锌片 |
50.9 |
| ③ |
30% |
锌粒 |
61.7 |
| ④ |
30% |
锌片 |
79.9 |
(1)写出锌与稀硫酸反应的化学方程式 。
(2)小明用如图装置收集并测量氢气的体积,其中量筒的作用是 ,氢气应从 (填e或f)管通入。
【收集证据】
(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是 。
【提出问题】(4)结论是 。
小聪同学家新换了水龙头,从说明书上了解到该水龙头是铜质镀铬。好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,邀请你一同参加。
【作出猜想】
猜想1.Cr>Fe>Cu; 猜想2. Fe>Cu >Cr; 猜想3.你的猜想是 。
【查阅资料】
(1)铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜。
(2)铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
【设计与实验】
小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸。
【结论与解释】
(1)小聪得到的结论是猜想 正确。
(2)实验前用砂纸打磨金属片的目的是 。
【知识运用】
将铬片投入FeSO4溶液中,反应 (填“能”或“不能”)进行。若能进行,
请你写出反应的化学方程式 。
(1)目前世界上一半以上的铜用于电力和电信工业,是因为铜具有 (填字母)
| A.导热性 | B.延展性 | C.导电性 | D.金属光泽 |
(2)我国第四套人民币的硬币从1999年开始发行,一元为钢芯镀镍(Ni),五角币为钢芯镀铜合金,一角币为铝合金或不锈钢。在选择铸造硬币的材料时需要考虑的因素是有 (填一条即可)。
①镍能与盐酸或稀硫酸反应,生成可溶于水的正二价镍的化合物,并放出氢气。其反应没有铁与酸反应剧烈。镍与盐酸反应的化学方程式为 .
②用镍片、硫酸亚铁溶液和 溶液做实验也能判断Ni 、Fe、Cu的金属活动性顺序。三种金属的活动性顺序为 。
(3)若将一定质量的Zn放入CuCl2和MgCl2的混合溶液中,充分反应后过滤,所得滤液中一定含有的溶质是 。
(4)活动课上小明将一枚五角币放在酒精灯火焰上加热片刻,发现表面变黑。
【假设与预测】假设Ⅰ.五角币加热变黑,是因为酒精灯内焰的黑烟附着在五角币的镀铜上;
假设Ⅱ.五角币加热变黑,是因为五角币上的镀铜与 ______发生了化学反应。
【实验与事实】
实验一:用洁净的干布擦一擦五角币上的黑色物质,黑色物质不易被擦去;再另取一枚五角币放在石棉网上,用酒精灯加热片刻,五角币也变黑。
实验二:取一块铜片放入小试管中并塞上橡皮塞,然后用酒精灯加热直至试管中铜片变黑;再将铜片反转到另一面,加热片刻,铜片不再变黑。
【解释与结论】上述实验一和实验二证实,假设 __ ___ 不成立。
【表达与交流】铜片在空气中加热,发生的化学反应方程式为___ ___ 。
生活中常遇见铜制品生锈的情况。活动课上,同学们设计实验对铜锈进行了如下探究活动。
探究活动一:验证铜锈的组成
【查阅资料】
① 铜锈为绿色,其主要成分是Cu2(OH)2CO3。
② 白色的硫酸铜粉末遇水能变为蓝色。
③ 碳不与稀硫酸反应。
④ 氧化铜为黑色固体,能与稀硫酸反应生成硫酸铜溶液。
【进行实验1】
同学们设计了下图所示装置并进行实验。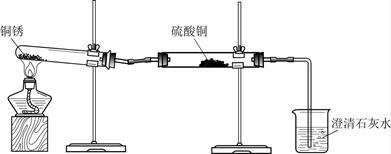
| 实验操作 |
实验现象 |
实验结论 |
| ① 按上图组装仪器,装入药品。 ② 加热铜锈,直至不再有气体产生,停止加热。 |
绿色固体变为黑色;硫酸铜粉末变为蓝色;烧杯中液体变浑浊。 |
加热铜锈生成的物质有_____;铜锈由_____元素组成;烧杯中发生反应的化学方程式为______。 |
| ③ 冷却后,向试管中固体加入适量稀硫酸,稍加热。 |
黑色固体溶解,溶液变为蓝色。 |
探究活动二:探究铜生锈的条件
【进行实验2】
同学们进行了下面的4个实验,每天观察一次现象,一段时间后,发现只有实验4中的铜丝生锈了,且与水接触的部分生锈更明显。