某化学兴趣小组对金属的性质做了如下探究,请你填写空格:
(1)用如图所示实验探究铁生锈的条件(每支试管中均放有完全相同的洁净铁钉):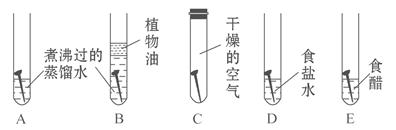
①甲同学认为:试管A发生的现象就能够说明铁的锈蚀是铁与空气中的氧气、水蒸气共同作用的结果。乙同学不同意他的观点,认为必须全面观察试管_________(填试管编号)发生的现象,并经过科学严谨的推理,才能得出上述结论。
②试管D和E实验的目的是进一步探究铁在_______的环境中是否更容易锈蚀。
③为防止金属锈蚀,除了采用覆盖保护膜等措施以外,还可以制成合金。这是因为合金与纯金属相比,其组成和内部结构发生变化,从而引起____________的变化。
(2)某同学向分别盛有等质量的铁粉和锌粒的试管中,倒入等质量、等溶质质量分数的稀硫酸,以“金属表面产生气泡的快慢”为标准来判断两种金属的活动性强弱。有的同学认为这种方案不够合理,理由是_________________________________________________________________________。
(3)将一定质量的铁粉放入硝酸铜、硝酸锌的混合溶液中,充分反应后过滤,所得固体中一定含有的物质是________,且反应后溶液质量比反应前________(填“增大”“减小”或“不变”)。
小明同学对“锌与硫酸反应快慢的影响因素”进行了探究。
【提出问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】
a.可能与硫酸的质量分数有关;
b.可能与锌的形状有关。
【查阅资料】
锌的化学性质比较活泼,在常温下的空气中,表面生成一层“保护膜”,可阻止进一步氧化。该“保护膜”可以和酸反应,但不产生氢气。
【设计并实验】小兵用不同质量分数的硫酸和不同形状的锌进行如下实验。
| 实验编号 |
硫酸的质量分数(均取20mL) |
锌的形状(均取1g) |
氢气的体积(mL)(均收集3分钟) |
| ① |
20% |
锌粒 |
31.7 |
| ② |
20% |
锌片 |
50.9 |
| ③ |
20% |
锌粒 |
61.7 |
| ④ |
30% |
锌片 |
79.9 |
(1)写出稀硫酸与锌反应的化学方程式______________________________。
(2)小兵用图装置收集并测量氢气的体积,其中量筒的作用是_______________________,氢气应从________(填e或f或g)管通入;
【收集证据】
(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是____________;
【得出结论】
(4)结论是_____________________________________________________;
【评价与反思】
(5)下表是小兵第①组实验的详细数据。
| 时段(均为1分钟) |
第1分钟 |
第2分钟 |
第3分钟 |
第4分钟 |
第5分钟 |
第6分钟 |
| H2的体积 |
3.1mL |
16.7mL |
11. 9mL |
9.6mL |
7.6mL |
6.0mL |
请描述锌与硫酸反应的先慢后快最后又变慢的原因___________________________;
(6)你认为锌与硫酸反应的快慢可能还受 因素影响?
(7)取某厂生产的生铁样品6g,与100g足量的稀硫酸充分反应后,称得剩余物质的总质量为105.8g。
①生成气体的质量为 克;
②该厂生产的生铁样品中铁的质量分数是多少?(写出具体的过程,结果精确到0.1%)
③该厂生产的生铁是否合格? (填“合格”或“不合格”)
下表是某种常见金属的部分性质:
| 颜色、状态 |
硬度 |
密度 |
熔点 |
导电性 |
导热性 |
延展性 |
| 银白色固体 |
较软 |
2.70g/cm3 |
660.4℃ |
良好 |
良好 |
良好 |
将该金属投入稀盐酸中,可产生大量的无色气体。根据上述信息回答以下问题:
推断该金属的一种用途__________;
金属的活动性比铜_______. (填“强”或“弱”);
请自选试剂,设计实验探究该金属与铁的活动性强弱.并完成下表.
| 你的一种猜想 |
|
| 验证方法 |
|
| 现象 |
|
| 结论 |
|
袋装食品中常用一种“双吸剂”保质,主要成分是铁粉和生石灰,同学们对一久置的双吸剂固体样品很好奇,设计了如下实验进行探究.
【提出问题】久置“双吸剂”的成分是什么?
【做出猜想】久置“双吸剂”中可能有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3
【实验探究1】
取固体样品研磨,用磁铁吸引,磁铁上沾有黑色粉末,说明“双吸剂”中一定有 。再用磁铁反复吸引后,残留固体用于后续探究活动。
【实验探究2】
| 实验操作 |
实验现象 |
实验结论 |
| 取少量实验探究1的残留固 体放入试管中,加入蒸馏水 |
试管外壁不发烫 |
固体中一定没有 。 |
【实验探究3】
【实验结论】
步骤②产生白色沉淀,说明久置的“双吸剂”中含有 ,其反应的化学方程式: 。
步骤③有气泡冒出,溶液变为黄色,写出溶液变为黄色所发生的化学方程式 ;根据步骤③的现象,说明久置的“双吸剂”中含有 和 。
【实验探究4】
联想到生铁是铁和碳的合金,某同学对生铁又进行了如下探究。
(1)为测定某生铁粉末状样品中铁的质量分数,进行如下实验。设计如图所示装置,实验时首先检验该装置是否密封的正确操作是 。(填序号)
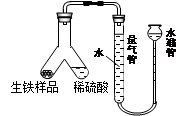
A.安装好装置并在量气管内加入水,上下移动水准管,若水准管中液面与量气管液面维持一定的高度差,说明装置密封。
B.安装好装置并在量气管内加入水,上下移动水准管,若水准管中液面与量气管液面始终相平,说明装置密封。
然后将生铁与稀硫酸放入Y型管中,塞紧橡皮塞。要使生铁样品与稀硫酸开始反应的操作方法为 (填字母序号)
A.将Y型管向左倾斜,使稀硫酸缓慢流入生铁样品中。
B.将Y型管向右倾斜,使生铁样品被缓慢倒入稀硫酸中。
实验结束后,根据量气管中的气体体积和密度,计算生铁样品中铁的质量分数,若测定的结果偏低,可能的原因是 (填字母序号)。
A.实验结束读数时未调节量气管和水准管中液面相平,立即读取气体体积
B.稀硫酸过量
C.反应结束未冷却到室温立即读数
(2)若称取11.5克生铁样品,放入装有100.0g稀硫酸的烧杯中恰好完全反应,在化学反应过程中对烧杯(包括溶液和残余固体,烧杯质量为60.0g)进行了四次称量
记录如表。
反应后所得溶液中溶质质量分数为多少?(结果精确到0.1%,写出计算过程,共2分)
计算过程:
| 反应时间 |
t0 |
t1 |
t2 |
t3 |
| 烧杯和药品的质量/g |
171.5 |
171.3 |
171.1 |
171.1 |
在趣味实验课上,老师将铝片、铜片打磨后,一起插入未成熟的新鲜橙子里面,同学们看到灯泡发光感到很惊奇。老师说这就是水果电池,通常用较活泼的金属做负极,利用橙汁内可以导电的有机酸溶液形成稳定的电流。请你回答下列问题:
(1)铝、铜可做电极,利用了金属的 ;
(2)在这个水果电池中能做正极的金属是 ;
(3)为比较这两种金属的活动性顺序,除铝片和铜片外还需选用的试剂是 (写出一种即可)。
生活中常遇见铜制品生锈的情况。活动课上,同学们设计实验对铜锈进行了如下探究活动。
探究活动一:验证铜锈的组成
【查阅资料】
① 铜锈为绿色,其主要成分是Cu2(OH)2CO3。
② 白色的硫酸铜粉末遇水能变为蓝色。
③ 碳不与稀硫酸反应。
④ 氧化铜为黑色固体,能与稀硫酸反应生成硫酸铜溶液。
【进行实验1】
同学们设计了下图所示装置并进行实验。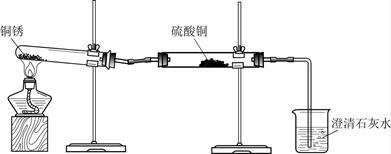
| 实验操作 |
实验现象 |
实验结论 |
| ① 按上图组装仪器,装入药品。 ② 加热铜锈,直至不再有气体产生,停止加热。 |
绿色固体变为黑色;硫酸铜粉末变为蓝色;烧杯中液体变浑浊。 |
加热铜锈生成的物质有_____;铜锈由_____元素组成;烧杯中发生反应的化学方程式为______。 |
| ③ 冷却后,向试管中固体加入适量稀硫酸,稍加热。 |
黑色固体溶解,溶液变为蓝色。 |
探究活动二:探究铜生锈的条件
【进行实验2】
同学们进行了下面的4个实验,每天观察一次现象,一段时间后,发现只有实验4中的铜丝生锈了,且与水接触的部分生锈更明显。
Ag、Cu、Fe和Al是生产或生活中广泛使用的金属。
⑴四种金属中,不是银白色的是 。
⑵铁制品容易锈蚀,铁生锈的条件是 。生锈的废钢铁可回收重新冶炼,用一氧化碳还原氧化铁的化学方程式为 。
⑶根据下图所示回答:滤渣中一定有的金属是 ,滤渣与稀盐酸反应的化学方程式为 ;滤液中的溶质是 。
京京在做金属与盐溶液的实验时,意外发现铝放入硫酸铜溶液后产生了无色无味气体,于是对此进行探究。
【提出猜想】①欢欢认为该气体可能是氧气②迎迎认为该气体可能是氢气③晶晶认为该气体可能是二氧化硫。欢欢认为晶晶的猜想错误,理由是 。
【进行探究】
| 实验操作 |
实验现象 |
结论 |
| ①__________________________ |
木条不复燃 |
欢欢猜想不成立 |
| ②用尖嘴导管将气体导出并引燃,同时在上方放一块干冷的玻璃片 |
|
迎迎猜想成立 |
【反思与探究】铝为什么能与硫酸铜溶液反应产生该气体?京京思考除与水有关外,还与什么粒子有关呢?资料表明硫酸铜在水中会产生铜离子和硫酸根离子。为此京京又进行以下实验:
| 实验操作 |
实验现象 |
实验结论 |
| 把铝丝放入20%的Na2SO4溶液 |
无气泡产生 |
|
| |
有气泡产生 |
产生气泡与铜离子有关 |
由上述实验可以推出,硫酸铜溶液中可能含有 物质。
小张同学在课外活动中探究金属的化学性质,进行了右图所示的实验,并根据实验得出了下列结论:Ⅰ.金属都能与空气中的氧气反应;Ⅱ.部分金属能与稀盐酸发生置换反应。
⑴小张同学的结论Ⅰ不正确。你认为具体的理由是 。
⑵小张同学的结论Ⅱ中的“部分金属”指的是 。
⑶根据你已有的知识,请你补充金属的另外一点化学性质 。
⑷小张同学通过查阅资料还发现,不同金属锈蚀的条件不同。铁锈的主要成分是Fe2O3·xH2O,铜锈(铜绿)的主要成分是Cu2(OH)2CO3。由此可判断铁生锈、铜生锈的相同条件是必须同时接触水和氧气;铜生锈条件还需要接触 。
某校研究性学习小组用如图装置进行镁条在空气中燃烧的实验,燃烧、冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶容积的70%.
(1)如图中A仪器的名称是 ,燃烧、冷却后打开止水夹,水能进入集气瓶中的原因是: .
(2)如镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的 %.现进入集气瓶中水的体积约为其容积的70%,根据空气的组成可推出减少的气体中肯定有 气体.
【发现问题】氮气是怎么减少的呢?
【查阅资料】镁条在氮气中燃烧,生成氮化镁Mg3N2固体,镁条还可以在二氧化碳中燃烧生成碳和氧化镁.
【假设】氮气与镁条反应而减少.
(3)通过以上探究,你会发现测定空气中氧气含量选择可燃物的时候应注意: .
最近,国外研究人员发明了一种在锌原子周围聚合咪唑钠(C 3H 3N 2Na)和苯并咪唑(C 7H 6N 2)两种有机物的新型玻璃,与硅原子周围聚合各种无机物的传统玻璃相比,具有更好的透光性和延展性。
(1)硅元素与锌元素之间最根本的区别是 不同。
(2)新型玻璃具有更好的延展性,这属于物质的 (选填"物理"或"化学")性质。
(3)请列式计算咪唑钠(C 3H 3N 2Na)中碳元素的质量分数。
用久置的镁条做实验时,需要用砂纸把表面的灰黑色打磨掉,直到露出光亮的银白色。实验小组同学对镁条表面“灰黑色外衣”的成分进行如下探究。
【提出问题】镁条表面“灰黑色外衣”的成分是什么?
【猜想与假设】
Ⅰ.是镁与空气中的氧气反应生成的氧化镁。
Ⅱ.是镁与空气中的二氧化碳反应生成的黑色碳单质。
Ⅲ.根据铜锈的成分是碱式碳酸铜,推测镁条表面的“灰黑色外衣”是镁在潮湿的空气中生锈得到的碱式碳酸镁。
同学们经讨论,从颜色上否定了只含有氧化镁,因为氧化镁是_____________。
【查阅资料】
① 碱式碳酸镁的性质有:受热可分解;常温下能与稀硫酸反应。
② 白色的硫酸铜粉末遇水能变为蓝色。
③ 碳不与稀硫酸反应,但与浓硫酸在加热条件下能反应并生成CO2、SO2和H2O。
同学们认为碳与浓硫酸反应生成三种产物的共同点是 (答出一点即可)。
【进行实验】
(1)同学们用久置的镁粉进行了如下实验。
| 实 验 装 置 |
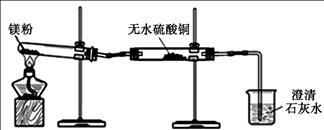 |
| 实 验 现 象 |
①无水硫酸铜粉末逐渐由白色变为蓝色 ②澄清石灰水变浑浊 |
| 结 论 |
久置的镁粉中除镁元素外,还含有的元素是 久置的镁粉中含有碱式碳酸镁 |
(2)同学们发现,经加热一段时间后,试管中镁粉会突然“噗”地燃烧起来,出现红热,很快停止,并有黑色固体粘附在试管壁上。
①将试管取下,冷却后加入足量稀硫酸,大部分固体溶解,并有气泡出现,但黑色固体没有消失。请写出有气体生成的一个反应化学方程式__________________。
②将实验①试管中的混合物进行_________________(填操作名称),除去其中溶液,向黑色固体中加入浓硫酸,加热。黑色固体全部溶解,得澄清溶液并伴有刺激性气味的气体产生。
实验(2)说明,镁在CO2中可以燃烧,生成了碳单质。
【实验结论】
综合上述实验现象,实验小组认为镁条表面“灰黑色外衣”中含有碳和碱式碳酸镁。
【反思与评价】
有的同学提出,实验(2)不足以证明镁条表面“灰黑色外衣”中含有碳,他的理由是_____________。
将一小块银白色的金属钠放置在空气中会发生下列变化:
钠(
)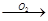 钠的氧化物
钠的氧化物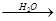 氢氧化钠溶液
氢氧化钠溶液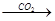 白色固体
白色固体
【提出问题】:常温下钠与氧气反应,产物有哪些?
【查阅资料】:钠的氧化物,除氧化钠(
)外还有过氧化钠(
),氧化钠与过氧化钠都能与水发生反应,方程式如下:
;
【作出猜想】:常温下钠与氧气反应的产物.
猜想1:
,
猜想2:
,
猜想3:
【实验探究一】:
| 实验操作 |
实验现象 |
实验结论 |
| 取少量钠的氧化物加入足量蒸馏水 |
猜想1正确 |
【继续探究】:钠在空气中放置一段时间得到白色固体的成分
【作出猜想】
猜想一:
猜想二:
和
【实验探究二】:
| 实验操作 |
实验现象 |
实验结论 |
| 1.取少量白色固体加入足量 |
产生白色沉淀 |
白色固体成分 和 |
| 2.过滤、取少量滤液加入 |
【实验反思】
(1)类比氧化铜与盐酸的反应,写出氧化钠与盐酸反应的化学方程式 。
(2)过氧化钠也能与盐酸反应,方程式为:
,X的化学式为 。
(3)能与酸反应只生成盐和水的氧化物称为碱性氧化物,请判断
碱性氧化物(填"是"或"不是")。
某同学在电视寻宝节目中,看到一些铜制文物上有绿色的锈迹,并对绿色锈迹产生了探究兴趣。
【查阅资料】
①绿色锈迹是碱式碳酸铜[Cu2(OH)2CO3],受热易分解。
②无水硫酸铜为白色粉末,遇水变蓝。
③碱石灰是CaO和NaOH的固体混合物,NaOH与CO2反应生成碳酸钠固体和水。
④氧化铜与稀硫酸反应生成蓝色溶液,碳粉不与稀硫酸反应也不溶解在稀硫酸中。
【发现问题】
查阅资料后,该同学将少量碱式碳酸铜放入试管中加热,发现试管中的固体由绿色变成黑色,同时试管壁上有无色液滴生成。
为了进一步确定碱式碳酸铜受热分解的产物,进行了如下探究:
探究一:碱式碳酸铜受热分解生成的黑色固体的成分。
【猜想与假设】该黑色固体可能是①碳粉;② ;③碳和氧化铜的混合物。
【设计方案】请帮助该同学完成下述实验报告。
| 实验操作与现象 |
实验结论 |
| |
猜想②正确 |
探究二:碱式碳酸铜受热分解还会生成CO2和H2O。
【进行实验】选择如下图所示装置进行验证。
步骤一:连接A和B,打开活塞,通入一段时间的空气。
步骤二,关闭活塞,依次连接装置A→B→ → (填“C”、“D”)。
步骤三:点燃酒精灯,观察到明显现象后,停止加热。
【解释与结论】
①当观察到 ,说明碱式碳酸铜受热分解生成了CO2和 H2O,写出C中反应的化学方程式 。
②Cu2(OH)2CO3受热分解的化学方程式 。
【反思与评价】
上述装置中A的作用是 。
(11分)废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),动物饲料硫酸亚铁的生产工艺之一如下图所示:
(1)在反应器中发生反应的化学方程式除Fe2(SO4)3+Fe=3FeSO4外还有: ; 。
(2)滤液M中肯定含有的溶质的化学式是 ;
(3)在实验室中完成操作A的玻璃仪器有玻璃棒、烧杯和 ;
(4)滤液M经过操作B可得硫酸亚铁晶体(FeSO4·7H2O)。已知硫酸亚铁的溶解度和析出晶体的组成如下表:
| 温度/℃ |
0 |
10 |
30 |
40 |
50 |
60 |
64 |
70 |
80 |
90 |
| 溶解度/g |
15.6 |
20.5 |
33.0 |
40.4 |
48.8 |
55.0 |
55.3 |
50.6 |
43.7 |
37.2 |
| 析出晶体 |
FeSO4·7H2O |
FeSO4·4H2O |
FeSO4·H2O |
根据溶解度表,硫酸亚铁晶体(FeSO4·7H2O)冷却结晶温度最高不超过 ℃;
(5)在化学反应中,若有元素化合价变化的反应定义为氧化还原反应。下列反应类型肯定是氧化还原反应的是 (填字母编号);
A.化合反应 B.置换反应 C.分解反应 D.复分解反应
在氧化还原反应中,若有元素的化合价升高,必有元素的化合价降低,且元素化合价升降总数相等。
将无水硫酸亚铁(FeSO4)隔绝空气加强热,分解产物有三氧化二铁和另两种氧化物,试写出该反应的化学方程式 。