已知镉(Cd)的金属活动性与锌相近,镉元素在化合物中常显+2价。
(1)锌与氧气加热时的化学方程式是 。
(2)镉的主要矿物是硫镉矿(硫化镉),硫化镉的化学式为 。
(3)含硫酸镉的废水,可用氢氧化钠溶液生成沉淀处理,化学方程式是 。
(4)将含氧化镉的细颗粒和炭粉混合后,隔绝空气加热至1200℃,可得镉蒸气和一氧化碳。
反应的化学方程式是 。
阅读下列材料,回答问题。(1)﹣(4)请在答题卡选择题区域填涂作答。
新型工程结构材料一蠕墨铸铁
在高碳铁液中加入稀土合金,得到断口呈“花斑”状,石墨为蠕虫状蠕墨铸铁(又称蠕铁)。蠕铁是具有片状和球状石墨之间的过渡形态铸铁,是一种具有良好力学性能(耐高温、强度大、断面敏感性小)、导热率高和抗氧化性能的新型工程结构材料。蠕铁广泛用于制造汽车发动机、汽车制动零件、排气管等。
国产蠕铁中的蠕化剂均含有稀土元素,如稀土硅铁镁合金、稀土硅钙合金等。国产蠕铁技术冲破了国外的技术封锁,助推我国发动机制造技术迈向世界领先水平。
(1)蠕状石墨属于 (A.单质B.化合物)。
(2)片状石墨、球状石墨内部 ( A.原子种类 B.原子排列方式)不同。
(3)蠕墨铸铁从材料分类看属于 (A.有机材料 B.合金)。
(4)蠕墨铸铁作为发动机材料主要是利用其独特的 (A.物理 B.化学)性质。
(5)请简述高端材料国产化的重要性: 。
化学就在我们身边。请你按要求回答下列问题:
(1)将50mL酒精和50mL水混合,得到溶液的体积小于100mL。试从微观的角度解释这一宏观现象:;
(2)在农村广泛使用沼气(主要成分是CH4),既可以改善人居环境,又使废弃物得到充分利用。请写出沼气充分燃烧的化学方程式:;
(3)在焊接钢管时,工人师傅通常用稀盐酸先将其表面的铁锈除去,反应的化学方程式是。
通过学习金属活动性后,我们知道铜与稀硫酸不能发生反应。某校化学兴趣小组对铜能否与浓硫酸发生反应产生了兴趣,并进行了如下探究:
实验Ⅰ:在一支试管中加入一小块铜片,再加入少量的浓硫酸,放置一段时间,无明显现象;
实验Ⅱ:对实验Ⅰ的试管加热,一段时间后有刺激性气味气体产生,待试管冷却后将其中的物质小心地倒入盛有少量水的烧杯中,得到蓝色溶液。
{查阅资料}
(1)反应生成的刺激性气味气体为二氧化硫。
(2)二氧化硫和二氧化碳化学性质相似,都能和石灰水反应。
{实验结论}
(1)在常温下,铜与浓硫酸 (填“能”或“不能”)发生反应。生成的二氧化硫中硫元素和氧元素的质量比是 。
(2)实验Ⅱ最后得到的蓝色溶液,说明反应生成了硫酸铜,已知该反应还生成了水,请写出铜与浓硫酸反应的化学方程式: 。
(3)铜与浓硫酸在加热的情况下可以发生反应,而铜与稀硫酸即使加热也不能反应,由此说明:物质的化学性质除了与物质的本身的性质有关外,还可能与 有关(填序号)。A、溶液的浓度 B、溶液的质量
(4)为了防止污染空气,兴趣小组可用 吸收生成的二氧化硫气体。
铁是生产、生活中应用很广泛的一种金属。下列是与铁的性质有关的部分实验图,请回答下列问题。
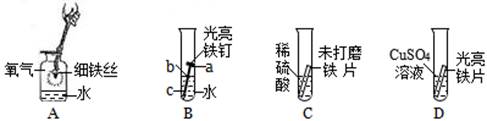
(1)A中细铁丝燃烧生成黑色固体物质的化学式是。
(2)B中铁钉最易生锈的部位是(填"a"、"b"或"c")。
(3)C中刚开始无气泡产生,溶液颜色逐渐由无色变为黄色,此时试管内发生反应的化学方程式是。
(4)D中反应一段时间后,试管内固体质量比反应前增大,据此推断,试管内溶液质量与反应前相比(填"增大"、"不变"或"减小")。
金属材料在生产生活中十分广泛
(1)根据下图金属应用实例推断,金属具有的物理性质有_________(答两点)
(2)生铁和钢都是铁的合金,二者性能不同的原因是_________;
(3)写出工业上以赤铁矿为原料炼铁过程中,一氧化碳与氧化铁发生反应的化学方程式_________;
每年因腐蚀而消费掉的金属材料数量惊人,铁生锈的条件是_________;防止金属腐蚀是保护金属资源的一条有效途径,保护金属资源的途径还有_________(答一条即可);
(4)将一定量的锌粉放入稀硫酸、硫酸亚铁、硫酸铜的混合溶液中,充分反应后过滤,向滤渣中加盐酸有气泡产生.则滤渣中一定含有固体的化学式是________;滤液中一定不含的物质名称是_________.
钢铁是使用最多的金属材料
(1)人类向自然界提取量最大的金属是铁,高炉炼铁的原料是铁矿石、空气、石灰石和。
(2)铝的活动性比铁强,但在生活中常在铁的表面涂上铝粉。其原因是。
(3)金属钴(
)与铁具有相似的化学性质。
固体是蓝色的,
溶液是粉红色的。现将金属钴投入稀盐酸中,发生化学反应
。该反应的实验现象为。
为探究锌、铁、铜三种金属的活动性,以及他们和氢元素的位置关系,小明设计了如下实验:
①小莉提出:上述实验中,省略某些实验也能达到目的,能被省略的实验是________(填字母序号)。
②将C、D试管反应后的废液倒入废液缸中,过滤,向所得滤液中加入铁粉,若有气泡产生,写出有气泡生成的反应方程式________________;若无气泡产生,则下列说法中,正确的是______________(填字母序号)。
A.滤液中一定含有硫酸铜 B.滤液中可能含有硫酸
C.滤渣中一定含有Fe D.滤渣中一定含有Cu
金属及金属材料在生产生活中应用十分广泛。请回答以下问题:
(1)下列厨房用品所使用的主要材料,不属于金属材料的是________(填字母序号)。
(2)人类有多种从自然界中提取金属的方法。其中我国是世界上最早采用湿法冶金提取铜的国家,请写出铁与硫酸铜溶液反应制取铜的化学方程式_______ _。并求算用这种方法制取铜,11.67t含杂质4%的生铁完全反应,在理论上可以换取 t铜。
(3)金属钠性质很活泼,只能以化合物的形式存在于自然界,其中氯化钠就是一种常见且很重要的含钠化合物。氯化钠的用途十分广泛,化工生产中经常采用电解熔融氯化钠的方法制取金属钠(也就是在通电条件下使融化的氯化钠分解),试写出该反应的化学方程式 (注:该反应的另一种产物是由双原子分子构成的气态物质)。工业生产还可以通过电解食盐水的方法制取烧碱,与此同时产生的氢气和氯气可以合成其它重要的化工产品。请运用“化学语言”描述工业上用氯化钠制取烧碱的过程。 。
金属与我们生活息息相关.
(1)铁锅用来做饭是利用了铁的 性.
(2)已知金属锰在金属活动性顺序中位于铝和锌之间。下列化学反应能发生的是 (填字母)
| A.Mn+2HCl=MnCl2+H2↑ | B.Mg+MnSO4=MgSO4+Mn |
| C.Fe+MnSO4= FeSO4+Mn | D.Mn+CuSO4 =MnSO4+Cu |
(3)某化学小组用一定量AgNO3和Al(NO3)3的混合溶液加入铜粉和锌粉,充分反应后过滤,得到溶液甲和固体乙,则:
①溶液甲中一定含有Al (NO3)3和Zn (NO3)2
②固体乙中一定含有Ag,可能含有Cu和Zn
③若溶液甲是蓝色,则溶液甲一定含有Al(NO3)3、Zn(NO3)2和Cu(NO3)2
④向固体乙上滴加盐酸有气泡产生,则溶液甲中一定没有AgNO3和Cu (NO3)2
上述四种说法正确的 (填序号)。
(4)为探究工业废水的综合利用,某化学小组在实验室中完成了以下实验。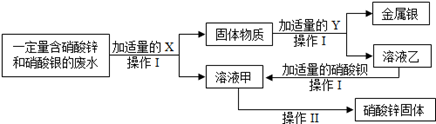
①x为 ;乙与硝酸钡反应的化学方程式为 。
②操作I和操作II中都要用到一种玻璃仪器。该仪器在操作II中的作用是 。
小明了解到水龙头是铜质镀铬,好奇的小明想探究铬(Cr)与常见金属铁、铜的活动性强弱,邀你一同参加:
【作出猜想】猜想1:Cr﹥Fe﹥Cu; 猜想2:Fe﹥Cu﹥Cr;猜想3:你的猜想
【查阅资料】(1)铬是有银白色金属光泽的金属,在空气中表面能生成致密的氧化膜。
(2)铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
【设计与实验】小明取大小相等的三种金属片,用砂纸打磨光亮,再取三支试管,分别放入等量的同种稀硫酸。
【结论解释】
(1)小明得到的结论是猜想 正确。
(2)将铬片投入FeSO4溶液中,反应 (填“能”或“不能”)进行。若能进行,请你写出反应的化学方程式: 。
潍坊电缆厂为增效节支,决定对生产中的废电缆进行回收利用。已知电缆绝缘皮是塑料,线芯是铜。为了回收金属铜,同时得到硫酸亚铁,设计了如下方案:
请完成下列问题:
(1)方案中①反应的现象是 ;
反应的化学方程式是 。
(2)纯铜在 (填“金属1”或“金属2”)中。
(3)溶液2中含有的溶质是 。
(4)你认为方案 好,理由是 。
向AgNO3、Cu(NO3)2、Al(NO3)3的混合溶液中,加入一定量的Zn粉,充分反应后过滤,得到滤液和滤渣。
(1)向滤渣中加入稀盐酸。如果有气泡产生,滤液中含有的溶质是 ;如果没有气泡产生,滤渣中一定含有的物质是 。
(2)滤液中如果加入盐酸,有白色沉淀生成,则滤液中一定有的阳离子是 。
(3)若反应后溶液质量减少,则可能发生的化学反应方程式是 。
2014年8月2日,江苏昆山市中荣金属制品有限公司抛光车间发生铝粉尘爆炸特别重大事故。经调查分析,事故原因为空气中浓度过高的铝粉遭遇明火产生爆炸。铝粉是一种银白色粉末;它能溶于酸、碱,生成氢气;它遇水受潮产生化学反应,放出氢气和热量,如果积热不散,容易引起燃烧或爆炸。
请根据上述信息,回答下列问题:
(1)铝粉具有银白色金属光泽,常被用作油漆涂料,这是利用了铝粉的 (填写“物理”或“化学”)性质;
(2)干燥的铝粉在空气中遇到明火极易爆炸,反应的化学方程式为 。
(3)铝丝在空气中不易燃烧,但铝粉在空气中遇明火却易发生爆炸,由此可以看出可燃物燃烧的剧烈程度跟 有关。
(4)在野外,铁路工人常把铝粉和三氧化二铁粉末按一定比例混合后点燃,反应生成高温的铁水,而把较短的钢轨焊接成较长的钢轨,请你写出该反应的化学方程式 。
(5)铝粉发生爆炸着火后能否用水灭火,说明原因 。