原电池中若用活泼性不同的两种金属作电极时,一般活泼性较强的作负极。现有A、B、C、D四种金属,只有A、C可与稀硫酸反应放出H2且A、C形成原电池时C作正极,D与B的硝酸盐溶液反应可置换出B的单质,则四种金属活泼性由弱到强的顺序是
A.A、C、D、B B.A、B、C、D
C.B、D、A、C D.C、A、D、B
下列说法中,完全正确的是()
| A. | 熄灭酒精灯可用嘴吹灭;加速溶解可用温度计搅拌 |
| B. | 金属都能与酸溶液反应;合金的熔点都高于它的成分金属 |
| C. | 硝酸钾属于复合肥;冰水共存物属于纯净物 |
| D. | 肥皂水能将硬水转化为软水;高温下一氧化碳能将赤铁矿冶炼成纯铁 |
有甲、乙、丙三种金属,只有甲在自然界中主要以单质形式存在,丙的盐溶液不能用乙制的容器盛放,则这三种金属的活动性由强到弱的顺序是
| A.甲>乙>丙 | B.丙>乙>甲 | C.丙>甲>乙 | D.乙>丙>甲 |
往200g 和 的混合溶液中加入铁粉。己知反应的先后顺序和化学方程式分别为: , 。下图为加入铁粉的质量与反应后剩余固体质量关系。则下列说法不正确的是()

| A. | B点后溶液的颜色为蓝色 |
| B. | D点对应纵坐标为6.4 |
| C. | 该200g溶液中的 质量分数为6.75% |
| D. | 取DE两点间的剩余固体加入盐酸,均有气泡产生 |
将红色的铜丝放在酒精灯火焰的外焰上加热,铜丝表面变为黑色。下列说法错误的是()
| A. | 红色铜丝表面变黑,是因为生成了氧化铜 |
| B. | 红色铜丝表面变黑,是因为铜发生了还原反应 |
| C. | 立即把变黑的铜丝插入稀硫酸中,溶液会出现蓝色 |
| D. | 立即把变黑的铜丝插入酒精中,铜丝变回红色 |
我国是世界上发现、利用金属锑(Sb)较早的国家之一,目前锑的产量位居世界第一。冶炼金属锑的过程中,发生的反应为: 。该反应的类型为()
| A. | 分解反应 | B. | 化合反应 |
| C. | 复分解反应 | D. | 置换反应 |
下列有关金属的叙述,正确的是()
| A. | 硬币、不锈钢锅都是合金材料,合金比各成分金属具有更优良的性能 |
| B. | 铝、铁、铜都是银白色固体,都能导电 |
| C. | 镁、铝都是活泼金属,相同质量时与足量的盐酸反应放出氢气的体积相同 |
| D. | 铁在空气中燃烧,冒出浓烈的黑烟,放出热量,生成黑色粉末 |
我国探月工程已经发现月球中含有种类繁多的矿物,其中有的是在地球上未曾发现过的矿产。下列月球矿物中属于单质的是
| A. | 钛铁矿 | B. | 铁锡合金 | C. | 纯铁颗粒 | D. | 硫化银颗粒 |
下列不能作为判断金属 三种金属活动性强弱的是()
| A. | 在纯氧中燃烧的现象 | B. | 与盐酸反应的快慢程度 |
| C. | 金属导电性强弱 | D. | 三种金属发现和利用的年代的先后顺序 |
小明为了比较 、 、 、 四种金属的活动性顺序,利用这四种金属单质、稀盐酸、 的硝酸盐溶液和 的硝酸盐溶液,进行有关实验,结果如下表("√"表示能反应,"-"表示不能反应,"空白"表示未做该实验)。请你判断四种金属的活动性顺序为()
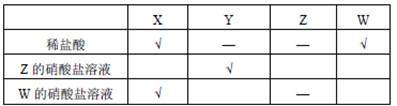
| A. | B. | C. | D. |
在硫酸铜溶液中加入一定量的锌粉和铁粉充分反应后,过滤可得到一些固体.向该固体中加入少量稀硫酸,可观察到有气体产生.下列对该固体的叙述正确的是
①一定有锌、②一定有铁、③一定有铜、④可能有锌、⑤可能有铁、⑥可能有铜.
| A.①、②、③ | B.②、③、④ | C.③、④、⑤ | D.①、②、⑥ |
为了获取"铁的金属活动性比铜强"的证据,可以采用()
| A. | 比较铁的利用范围是否比铜广 | B. | 观察铁是否能置换硫酸铜溶液中的铜 |
| C. | 观察铁表面的锈迹是否比铜多 | D. | 比较铁的相对原子质量是否比铜小 |
钛合金是生产链条钢、锚链钢等的重要原料。如果要比较钛( )和铁的金属活动顺序,以下方法不能达到目的的是
| A. | 查阅初中化学课本上的金属活动顺序表 |
| B. | 利用金属钛和 溶液进行实验 |
| C. | 利用金属铁和 溶液进行实验 |
| D. | 利用金属钛、金属铁与稀硫酸进行实验 |