用廉价金属回收贵重金属是工业生产中的一道重要程序.某化学兴趣小组的同学在实验室中进行了模拟实验.向含有硝酸铜和硝酸银的废液中加入一定量的铁粉,充分反应后过滤,得到滤液和滤渣.下列说法正确的是()
| A. | 滤液中最多含有三种溶质 |
| B. | 滤液质量比反应前原溶液质量大 |
| C. | 滤液中一定含有硝酸亚铁,滤渣中一定含有银 |
| D. | 若反应后所得滤液呈浅绿色,则滤渣中一定含有铁、铜、银 |
用实验探究铝和铜的金属活动性强弱,若提供的试剂只有:氯化铜溶液、氯化铝溶液、铝、铜和稀盐酸,对此下列说法正确的是
| A. | 最多只能设计一种实验方案 |
| B. | 氯化铜溶液是不可或缺的试剂 |
| C. | 选用两种合适的试剂即可实现实验目的 |
| D. | 氯化铝溶液中加入铜不能探究金属活动性强弱 |
将相同状态的铁和镁分别与相同质量分数,足量的稀盐酸反应,产生氢气的质量与反应时间的关系如图所示,下列说法正确的是
| A.铁和镁的质量相同 |
| B.甲是铁、乙是镁 |
| C.铁和镁完全反应所消耗的稀盐酸质量相同 |
| D.反应后溶液的质量均减少 |
根据下面的实验过程和提供的数据,可知样品中碳的质量分数为()

| A. | 44% | B. | 46% | C. | 54% | D. | 64% |
将一定质量金属M的粉末放入盛有硝酸铜溶液的烧杯中,充分反应后溶液呈无色;继续向烧杯中加入一定量的硝酸银溶液,待充分反应后过滤,得蓝色滤液和滤渣。根据实验分析,以下结论错误的是()
| A. | 金属活动性顺序:M> > |
| B. | 滤液中一定含有M的阳离子和 |
| C. | 滤渣中一定含有 和 |
| D. | 向滤液中滴加稀盐酸,可能产生白色沉淀 |
向一定量的 与 的混合溶液中加入一定量的锌粉,充分反应后过滤。分析判断下列说法正确的是
| A. | 滤渣中一定有 ,可能有 |
| B. | 滤渣中一定有 、 ,可能有 |
| C. | 滤液中只有 |
| D. | 滤液中一定有 ,可能有 |
金属 与 溶液发生反应: ,下列说法正确的是
| A. | 可能是铝 |
| B. | 的金属活动性比 强 |
| C. | 反应前后 的化合价发生了改变 |
| D. | 在金属活动性顺序里, 一定排在氢前 |
下列图像不能正确反映其对应关系的是()
| A. |
|
| B. |
|
| C. |
|
| D. |
|
除去下列各物质中混有的少量杂质,所用试剂、方法正确的是()
| 序号 |
物质 |
杂质 |
试剂、方法 |
| A |
|
点燃 |
|
| B |
粉 |
粉 |
稀盐酸,过滤 |
| C |
溶液 |
盐酸 |
适量的氢氧化钠溶液 |
| D |
溶液 |
|
过量铁粉,过滤 |
取等质量的甲、乙、丙三种金属,分别投入相同浓度的盐酸中,只有甲有气泡产生;再取一小块乙投入丙的硝酸盐溶液中,乙的表面没有丙析出。则甲、乙、丙三种金属的活动性顺序是()
| A. | 甲>乙>丙 | B. | 甲>丙>乙 | C. | 丙>乙>甲 | D. | 乙>丙>甲 |
原电池中若用活泼性不同的两种金属作电极时,一般活泼性较强的作负极。现有A、B、C、D四种金属,只有A、C可与稀硫酸反应放出H2且A、C形成原电池时C作正极,D与B的硝酸盐溶液反应可置换出B的单质,则四种金属活泼性由弱到强的顺序是
A.A、C、D、B B.A、B、C、D
C.B、D、A、C D.C、A、D、B
将红色的铜丝放在酒精灯火焰的外焰上加热,铜丝表面变为黑色。下列说法错误的是()
| A. | 红色铜丝表面变黑,是因为生成了氧化铜 |
| B. | 红色铜丝表面变黑,是因为铜发生了还原反应 |
| C. | 立即把变黑的铜丝插入稀硫酸中,溶液会出现蓝色 |
| D. | 立即把变黑的铜丝插入酒精中,铜丝变回红色 |
小明为了比较 、 、 、 四种金属的活动性顺序,利用这四种金属单质、稀盐酸、 的硝酸盐溶液和 的硝酸盐溶液,进行有关实验,结果如下表("√"表示能反应,"-"表示不能反应,"空白"表示未做该实验)。请你判断四种金属的活动性顺序为()
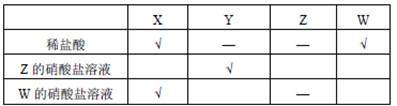
| A. | B. | C. | D. |
在硫酸铜溶液中加入一定量的锌粉和铁粉充分反应后,过滤可得到一些固体.向该固体中加入少量稀硫酸,可观察到有气体产生.下列对该固体的叙述正确的是
①一定有锌、②一定有铁、③一定有铜、④可能有锌、⑤可能有铁、⑥可能有铜.
| A.①、②、③ | B.②、③、④ | C.③、④、⑤ | D.①、②、⑥ |