下列图①~④分别与相应的操作过程相对应,其中正确的是
① ② ③ ④
| A.①在恒温的条件下,将足量的氯化钠饱和溶液蒸发适量的水分 |
| B.②向露置在空气中部分变质的氢氧化钠溶液中加入稀盐酸 |
| C.③向氢氧化钠溶液中不断加水稀释 |
| D.④相同质量的且过量的锌粉和铁粉,分别与质量和质量分数相同的稀盐酸反应 |
下图是A、B两种固体物质的溶解度曲线。据图回答:
(1)P点表示的意义是 。
(2)把t2℃时等质量A、B两物质的饱和溶液降低到t1℃,析出晶体较多的是 。
(3)当A中含有少量B物质时,可采用 的方法提纯A物质。
(4)t2℃时,将90gA物质投入到100g水中,得到A物质的 (填“饱和”或“不饱和”)溶液,此时溶液的质量是 g。
(5)t2℃时,将30gA物质投入到100g水中,可再采取哪些具体措施,使之变为饱和溶液? 。
下列四个图像中,能正确表示对应变化关系的是
 |
 |
 |
 |
| A.向一定量稀盐 酸中加水稀释 |
B.一定温度下,向不饱和硝酸钾溶液中加入硝酸钾 |
C.加热一定量的 高锰酸钾固体 |
D.向盐酸和氯化镁的混合溶液中滴加氢氧化钾溶液 |
(1)下列是初中化学中的一些重要实验。请回答: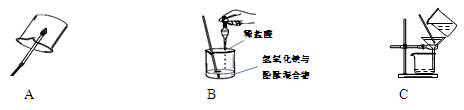
①A是氢气或甲烷的燃烧实验,点燃前必须 ;
②B实验中能够说明盐酸与氢氧化钠发生了反应的现象是 ;
③C是除去粗盐中难溶性杂质实验中的过滤操作,过滤后发现滤液仍然浑浊,其可能的原因是 (答出一种原因即可)。
(2) 如图所示是A、B、C三种物质的溶解度曲线,据此图回答: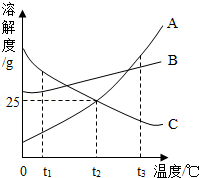
①t1℃时,A、B、C三种物质的溶解度由大到小的顺序是 ;
②t2℃时,将30gA放入100g水中,充分搅拌后,所得溶液的溶质质量分数是 ;
③t3℃时,将等质量A、B两种物质的饱和溶液降温到t2℃时,析出晶体质量较大的是 ;
④t3℃时,将25gC放入100g水中,充分搅拌后得到C的饱和溶液,在不改变溶剂量的前提下,将其变为不饱和溶液的方法是 .
右图是a、b、c三种物质的溶解度曲线。把t1℃时三种物质的饱和溶液温度升高到t2℃,则三种溶液的溶质质量分数大小关系是
| A.a >b >c | B.c >b >a |
| C.b >a =c | D.b >a >c |
下图甲是A、B两种固体物质的溶解度曲线图,下列说法正确的是
A.在t2℃时,P点表示A物质的饱和溶液
B.A、B两物质形成的溶液都可以通过同一种方法从不饱和转化为饱和溶液
C.如乙图所示,分别将Wg两物质的饱和溶液于烧杯中,然后分别放入盛有同样冰块的小烧杯。一段时间后,两溶液中都析出晶体,溶质的质量分数下降
D.提纯混有少量B的A物质常用蒸发结晶的方法比较好
下列关于图像的描述正确的是
① ② ③ ④
| A.图①表示室温下向饱和石灰水中加入一定量氧化钙,并恢复至室温 |
| B.图②表示把布满锈迹的铁钉投入到过量的稀硫酸中 |
| C.图③表示向氢氧化钠溶液中加入大量的水 |
| D.图④表示将饱和硝酸钾溶液恒温蒸发水份 |
下表是KNO3 、NaCl在不同温度下的溶解度:
| 温度(℃) |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
|
| 溶解度/g |
KNO3 |
13.3 |
20.9 |
32 |
45.8 |
64 |
85.5 |
110 |
138 |
169 |
202 |
246 |
| NaCl |
35.7 |
35.8 |
36 |
36.3 |
36.6 |
37 |
37.3 |
37.8 |
38.4 |
39 |
39.8 |
(1)将20℃时相同质量的KNO3 、NaCl饱和溶液冷却至0℃,析出晶体多的是 。
(2) 60℃时,将50g硝酸钾固体投入50g水中,充分溶解后可得到硝酸钾 溶液(填“不饱和”或“饱和”或“不能确定”)。将温度降到20℃,计算溶液中溶质的质量分数 (精确到0.1%)。
(3)将20℃时KNO3和NaCl的饱和溶液同时升高一定温度后,所得溶液中溶质的质量分数的大小关系是:硝酸钾 氯化钠(填“>”或“<”或“=”)。
下列四个图象表示四种对应的操作过程,其中正确的是( )
| A.向pH=10的NaOH溶液中不断加水 |
| B.把相同质量的铝和镁放入足量的等质量等浓度的盐酸中 |
| C.把铁棒放入硫酸铜溶液中 |
| D.一定温度下向10%的硝酸钾溶液中不断加入硝酸钾晶体。 |
20℃时,将等质量的甲、乙固体(不含结晶水),分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2(不考虑水分蒸发),甲、乙固体的溶解度曲线如图3.
下列说法正确的是( )
| A.图1中乙溶液一定不饱和 | B.图2中两溶液中溶质质量分数一定相等 |
| C.图3中N表示甲的溶解度曲线 | D.图2中两溶液降温至30℃一定都不会析出晶体 |
下图是a、b、c三种物质的溶解度曲线。根据图示判断回答下列问题:
(1)t1℃时a、b、c三种物质的溶解度由小到大的顺序是
(2)t1℃时,60g a的饱和溶液中含有a物质 g
(3)a、b的饱和溶液从t2℃降温至t1℃时,析出的晶体质量
是a b(填“大于”、“小于”、“无法判断”)
(4)a、b、c三种物质的饱和溶液从t2℃降温至t1℃时,所得溶液的
溶质质量分数大小顺序为
2014年3月22日是第22届“世界水日”,请你根据所学,回答下列问题。
(1)下图是简易净水装置。该净水装置 (填“能”或“不能”)将河水变成纯水。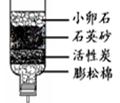
(2)二氧化氯(ClO2)是新一代饮用水的消毒剂,工业上将氯气(Cl2)通入亚氯酸钠(NaClO2)溶液中反应来制取二氧化氯,同时生成氯化钠。写出该反应的化学方程式: 。
(3)小丽收集到一瓶浑浊的河水,她要模拟自来水厂的净水过程,最终制成蒸馏水,
过程如下图所示。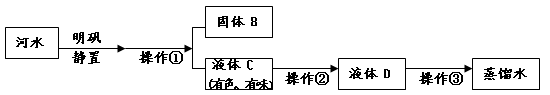
操作①的名称是 ;操作②应选用的装置是下图中的 (填序号,下同);操作③应选用的装置是下图中的 。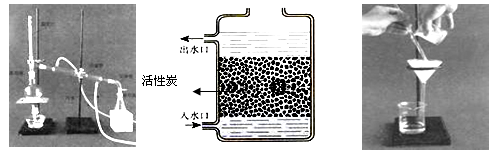
(Ⅰ) (Ⅱ) (Ⅲ)
(4)小丽取少量液体D于试管中,加入少量肥皂水,振荡,发现有较多浮渣产生,说明液体D是 水。(填“硬”或“软”)
(5)如图是甲、乙两种物质的溶解度曲线,回答下列问题: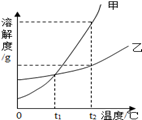
①________℃时,甲、乙两种物质的溶解度相等;
②若固体甲中含有少量乙时可用_____________方法提纯甲(填”蒸发结晶“或”冷却结晶“);
③t2℃用等质量的甲、乙两种物质配制甲、乙的饱和溶液需要水的质量:
甲______乙(填“>”“<”或“=”);
④实验室需要配制50g溶质质量分数为4%的氢氧化钠溶液,所需固体氢氧化钠的质量为___ __g,主要操作步骤是:计算、_______、量取、溶解.在溶解过程中用玻璃棒搅拌,其作用是______ ___.
下列图象能正确反映实验过程中相应量变化的是
① ② ③ ④
| A.图①:将接近饱和的硝酸钾溶液缓慢降温 |
| B.图②:向一定量的氢氧化钡溶液中加过量稀硫酸 |
| C.图③:向氢氧化钠溶液中加水 |
| D.图④:向一定量的稀硫酸中加入过量的锌 |
下列实验内容中,量的关系(“—”前的量为横坐标,“—”后的量为纵坐标)符合下图所示变化趋势的是
| A.向氢氧化钠溶液中滴加盐酸时,盐酸—水 |
| B.加热高锰酸钾时,时间—剩余固体中氧元素 |
| C.向硫酸铜溶液中加入铁粉,铁粉—反应后溶液的质量 |
| D.过氧化氢溶液与二氧化锰制取氧气,时间—溶液中溶质质量 |
水和溶液在生命活动和生产、生活中起着十分重要的作用。
(1)净水器中经常使用活性炭,主要利用活性炭的 性。
(2)下图实验中,当试管1中气体的体积为6mL时,试管2中气 体体积约为 mL;反应的化学方程式是 。
(3)农业生产常用溶质的质量分数为10% ~ 20%的NaCl溶液来选种。现将300g 25%的NaCl溶液稀释为10%的NaCl溶液,需要加水的质量为 g。
(4)甲、乙两物质的溶解度曲线如右图所示。20℃时,将等质量的甲、乙两种固体,分别加入盛有10 g水的A、B试管中,充分溶解后,可观察到如图所示的现象。则20℃ t℃(填“>”、“<”或“=”)。
20℃时,对A试管进行如下操作,最终A试管中溶液
溶质的质量分数一定发生变化的是 (填字母序号)。
A.加少量水 b.加入少量甲物质
c.升温到40℃ d.蒸发部分溶剂,恢复到20℃
e.加入少量40℃甲的饱和溶液,恢复到20℃