北京市延庆区中考一模化学试卷
下列符号与所表示的涵义正确的是
| A.2O—2个氧元素 | B. —1个钠离子 —1个钠离子 |
| C.3Al3+—3个铝原子 | D.CO2—1个二氧化碳分子 |
水是生命之源,下列有关水的说法不正确的是
| A.水是一种最常见的溶剂 | B.水分子由氢分子和氧原子构成 |
| C.水污染与人类活动紧密相关 | D.保持水的化学性质的最小粒子是水分子 |
实验结束后,用灯帽熄灭酒精灯依据的主要原理是
| A.清除酒精 | B.降低酒精的着火点 |
| C.隔绝空气 | D.降低酒精灯的温度 |
下列物质在氧气中燃烧现象的叙述不正确的是
| A.红磷:大量白烟 | B.木炭:发出白光 |
| C.铁丝:火星四射 | D.硫粉:淡蓝色火焰 |
下列关于溶液的叙述正确的是
| A.凡是均一、稳定的液体都是溶液 | B.溶液都是无色透明的 |
| C.溶液是均一、稳定的混合物 | D.稀溶液一定是不饱和溶液 |
下列物质的用途与物质化学性质无关的是
| A.用铜丝做导线 | B.用氮气充入灯泡可延长使用寿命 |
| C.用稀有气体作金属焊接保护气 | D.用生石灰作食品干燥剂 |
下列有关“化学之最”的叙述不正确的是
| A.人体中含量最多的物质是水 | B.相对分子质量最小的气体是氢气 |
| C.地壳中含量最多的金属元素是铁 | D.天然存在最硬的物质是金刚石 |
小明用下图所示装置进行“微粒是不断运动”的探究。一段时间后,可观察到紫色石蕊溶液变红,则物质A是 
| A.浓氨水 | B.浓盐酸 |
| C.浓硫酸 | D.浓食盐水 |
下列实验需要使用烧杯的是
①过滤 ②稀释浓硫酸 ③用过氧化氢溶液制取氧气
④用固体溶质配制一定质量分数的溶液
| A.只有①② | B.只有①④ | C.只有①②④ | D.①②③④ |
下列关于耐高温新型陶瓷材料氮化硅(Si3N4)的叙述正确的是
| A.氮化硅中氮元素的质量分数为40% | B.氮化硅是有机高分子合成材料 |
| C.氮化硅中硅与氮的质量比为3: 4 | D.氮化硅的相对分子质量是140g |
锰元素的相关信息如图所示。下列说法中正确的是
| A.属于金属元素 | B.原子核内中子数为25 |
| C.原子的核外电子数为30 | D.在地壳中的含量为54.94% |
下列方法可行,且化学方程式书写正确的是
| A.用稀盐酸除铁锈:Fe2O3+4HCl=2FeCl2+2H2O |
| B.用稀硫酸洗去试管壁上附着的铜:Cu+H2SO4 = CuSO4+H2↑ |
| C.用盐酸除去氢氧化钠溶液中的碳酸钠:Na2CO3+2HCl = 2NaCl+H2O+CO2↑ |
| D.用含碳酸氢钠的药物治疗胃酸过多:NaHCO3+HCl = NaCl+CO2↑+H2O |
下列操作过程中,利用了乳化原理的是
| A.将硬水变为软水 | B.用洗洁精洗去餐具上的油污 |
| C.用汽油洗去衣服上的油污 | D.用稀盐酸洗去铁制品表面的铁锈 |
把一定质量的锌粉放入Cu(NO3)2溶液中,充分反应后过滤,向滤渣中加入稀盐酸,有气体产生。根据以上现象,下列判断滤渣中的成分正确是
| A.只有Cu | B.只有Zn |
| C.一定有Zn和Cu | D.一定有Cu,可能有Zn |
下列四种物质中,有一种物质在适当条件下能与其他三种物质反应,这种物质是
| A.氧气 | B.铁 | C.盐酸 | D.硫酸铜溶液 |
已知氢氧化铜为蓝色固体,难溶于水,稀硫酸能与其发生反应,化学方程式为
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O。下列说法中,不正确的是
| A.反应类型为复分解反应 | B.反应后溶液为蓝色 |
| C.参加反应的两种物质的质量比为1:2 | D.反应前后各元素质量均不发生改变 |
甲和乙两种固体的溶解度曲线如图所示。下列说法中,正确的是
| A.10℃时,甲的溶解度大于乙的溶解度 |
| B.通过降温可以将甲的饱和溶液变为不饱和溶液 |
| C.20℃时,甲溶液中溶质的质量分数一定等于乙溶液中 溶质的质量分数 |
| D.30℃时,分别在100 g水中加入40 g甲、乙,同时 |
降温至20℃,甲、乙溶液均为饱和溶液
下列有关化学实验的“目的→操作→现象→结论”的描述都正确的是
| 选项 |
目的 |
操作 |
现象 |
结论 |
| A |
比较铝和铜的金属活动性 |
将砂纸打磨过的铝丝 浸入到硫酸铜溶液中 |
铝丝表面有红色固体析出 |
铝比铜活泼 |
| B |
检验露置在空气中的氢氧化钠溶液是否变质 |
取氢氧化钠溶液,滴入稀盐酸 |
开始时没有观察到气泡产生 |
氢氧化钠溶液没有变质 |
| C |
探究物质溶解于 水时的热量变化 |
向一定量水中加入硝酸铵晶体,充分搅拌 |
溶液温度下降 |
盐类物质溶解于水时,都会吸热 |
| D |
检验集气瓶中是否集满二氧化碳 |
将燃着的木条伸入集 气瓶中 |
木条火焰熄灭 |
集气瓶中已集满 二氧化碳 |
下列实验内容中,量的关系(“—”前的量为横坐标,“—”后的量为纵坐标)符合下图所示变化趋势的是
| A.向氢氧化钠溶液中滴加盐酸时,盐酸—水 |
| B.加热高锰酸钾时,时间—剩余固体中氧元素 |
| C.向硫酸铜溶液中加入铁粉,铁粉—反应后溶液的质量 |
| D.过氧化氢溶液与二氧化锰制取氧气,时间—溶液中溶质质量 |
化学与生活密切相关。
(1)下列含碳元素的物质中,属于有机物的是 (填字母序号)。
A.碳酸钙 B.乙醇(C2H5OH) C.二氧化碳
(2)化石燃料主要包括煤、 和天然气,它们都含有碳元素,其中天然气的主要成分是 (写化学式)。
(3)在日常生活中应注意合理摄取营养物质和人体必需的元素。有些青少年不爱吃蔬菜、水果,影响生长发育,这主要是由于摄入 不足而引起的。
(4)饼干中常添加碳酸钙,其作用是 。
(5)下列日常生活中的做法,符合“低碳生活”理念的是 。
A.节约使用纸张 B.分类回收处理垃圾
C.减少使用塑料袋 D.减少使用一次性纸杯
化学反应有着广泛的应用。
(1)不能用铁质容器存放硫酸铜溶液,因为铁与硫酸铜溶液会发生化学反应,此反应中铜元素的化合价由 变为 。
(2)人的胃液里含有胃酸,若胃酸分泌过多会引起胃病。服用“胃舒平”(主要成分是氢氧化铝)可缓解病痛。则该药用于治疗的化学原理是(用化学方程式表示)_______________________________________________。
(3)化肥对提高粮食产量具有重要的作用。尿素[CO(NH2)2]是一种常用的化肥,工业上生产尿素的反应的微观示意图如下: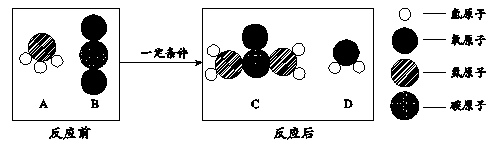
尿素由 种元素组成,属于 (填“氮”、“磷”或“钾”)肥。
生产尿素的反应中,A与B的质量比为 。
(6分)水是最普通、最常见的物质之一。
(1)长期是饮用硬水不利于健康,硬水和软水的区别是_______________________。
(2)电解水可证明水由氢、氧两种元素组成,该反应的化学方程式为 。
(3)水是重要的溶剂和化工原料。氯碱工业以饱和食盐水为原料获得烧碱等化工产品,反应原理为:2NaCl+2H2O通电2NaOH+H2↑+Cl2↑。
① 20℃时,NaCl的溶解度是36g。该温度下,饱和食盐水中溶质与溶剂的质量比为 。
② 烧碱可用于处理硫酸泄漏,反应的化学方程式为 。
(4)水在化学实验中具有重要作用。将铁丝放在
潮湿的空气中(如图所示),一段时间后,
观察到导管内液面上升;打开K,滴加稀盐酸,
观察到的现象是 。
(6分)铜是人类最早利用的金属之一。
(1)下列铜制品中,利用金属导热性的是 (填字母序号)。
A.铜质奖牌 B.铜导线 C.铜火锅
(2)验证铜、银的活动性,可以选用的试剂是 。
(3)利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液,主要流 程如下(反应条件已略去): 已知:2Cu+2H2SO4+O2△2CuSO4+2H2O
① 过程Ⅱ中分离操作的名称是 。
② 过程Ⅲ中有气体产生,反应的化学方程式为 。
溶液A中一定含有的溶质的物质有 。
①~⑥为初中化学常见物质的相互转化关系(反应条件已略去)。其中只有D、E、M为单质,且D为最轻的气体。H和L的组成元素相同。
① A+B→C ② A→D+E ③ F→A+E ④ G+K→H+A
⑤ G+M→L+D ⑥ Q+K→M+B
(1)则D为__________________。
(2)写出物质的化学式:C 、F 。
(3)写出反应的化学方程式:③ ;④ ;⑥ 。
下图甲~丁是实验室制取氧气的装置图。
(1)写出仪器的名称:① 、② 。
(2)甲、乙装置都可用于实验室制氧气,用乙装置制氧气的优点是 (填字母)。
A.节约能源 B.可较快获得氧气
C.可随时添加药品 D.操作简单、安全
(3)丙、丁装置都可用于实验室收集氧气。下面是对两种收集方法的相关比较(使用容积相同的集气瓶收集氧气)。
| 比较的方面 |
排水法 |
向上排气法 |
结论 |
| 方法可行性 |
O2难溶于水,且不与水反应。 |
O2的密度比空气_____(填“大”或“小”),且不与空气中的物质发生反应。 |
两种方法均可行。 |
| 收集O2的纯度 |
分别用排水法和向上排空气法收集两瓶氧气(A和B), 放入两支相同的蜡烛,可观察到B瓶内的蜡烛熄灭较早。  |
结论: _______________ _______________。 |
下面三个实验采用的是对比实验方法进行的有关探究。

实验三 F G
(1)用实验一所示装置进行二氧化性质的探究。
当长颈漏斗中的稀盐酸与锥形瓶中的大理石接触后,有大量气泡产生,该反应的化学方程式是 ;C中观察到的现象是 。
(2)用实验二进行石灰石性质的探究。
用两支坩埚钳分别夹持大小相同的石灰石固体d、e,向 E中酒精灯的火焰通氧气,受热相同时间后冷却,将固体d、e固体分别放入盛有酚酞溶液的烧杯中,前者溶液不变色,后者溶液变为红色。则向酒精灯火焰通氧气的目的是 。通过上述实验对比分析,可得出的结论是 。
(3)用实验三所示装置探究二氧化碳与氢氧化钠发生了反应。
①小军同学用实验三装置进行实验,分别量取50 mL水和氢氧化钙溶液放入F、G中,关闭K,通入约500 mL二氧化碳,观察到的现象F中无明显变化,G溶液变浑浊。这说明500mLCO2_______________溶于50mL水中(填是“部分”和“全部”)。
②小军同学用洗涤干净的实验三装置继续进行实验,分别量取50 mL氢氧化钠和氢氧化钙溶液放入F、G中,关闭K,通入约500 mL二氧化碳,F、G中均无明显变化。此实验可以说明二氧化碳和氢氧化钠发生了反应,其理由是____________________________________________________。
(1)小方用下图所示装置对二氧化碳的灭火实验进行研究,
观察到的现象是____________________________________。
实验的结论是______________________________________。
(2)【提出问题】二氧化碳能否支持燃烧?
【猜想假设】镁能在二氧化碳中燃烧。
【查阅资料】①氧化镁、氢氧化镁均是白色难溶于水的固体。
②MgO+2HCl= MgCl2+H2O 、
③MgCl2+2NaOH=Mg(OH)2↓+2NaCl 。
【实验探究】
①下图中镁带剧烈燃烧,冒白烟,有黑色固体生成,并放出大量的热。
②为检验生成物的成分,做如下实验。
| 实验步骤 |
实验现象 |
实验结论和化学方程式 |
|
| 向广口瓶中加入过量盐酸,充分反应后过滤,在滤纸上留有黑色固体。 |
I、将黑色固体收集、洗涤、干燥后,点燃,在火焰上方罩一个蘸有澄清石灰水的烧杯。 |
黑色固体燃烧,烧杯内壁出现白色浑浊。 |
黑色固体是______; 反应的化学方程式是: ___________________。 |
| II、取少量滤液于试管中,逐滴加入氢氧化钠溶液。 |
开始_______,后有白色沉淀产生。 |
白烟的成分是______。 |
③为了回收II中的白色沉淀,证明沉淀完全的实验方法是______________________
___________________________________(要求写出步骤、试剂、现象和结论)。
【反思提高】实验室中由某些活泼金属引起的着火,不能用二氧化碳灭火,应用细沙灭火。
将15.8 g高锰酸钾放入试管中加热制取氧气,充分反应至不再产生气体为止。
计算:剩余固体物质的总质量是多少克?(已知:2KMnO4 ="=" K2MnO4+MnO2+O2↑)


 粤公网安备 44130202000953号
粤公网安备 44130202000953号