蛋白质在人体胃肠内与水反应,最终生成氨基酸被人体吸收。
丙氨酸(化学式为C3H7O2N)就是其中的一种。请回答下列问题:
(1)丙氨酸的相对分子质量是______________
(2)丙氨酸中C、H、O、N各元素质量比为____________
(3)丙氨酸中氮元素的质量分数 (计算结果精确到0.1%)。
化学与生活息息相关。
① 加铁酱油中的“铁”是指 (1) (填“单质”、“原子”或“元素”)。
② C60能抗辐射,它的摩尔质量是(2) ,与它互为同素异形体的一种物质是(3) (填物质名称)。
③ 维生素C的化学式为C6H8O6。1molC6H8O6中含有 (4) g碳元素,与 (5) molCO2所含氧原子个数相等。
褪黑素是大脑分泌的一种综合性激素,化学式为: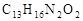 ,它具有促进睡眠的作用。
,它具有促进睡眠的作用。
(1)褪黑素是由 种元素组成的,
(2)褪黑素分子中碳、氧原子的个数比为_______________________,
(3)褪黑素中氢、氧元素的质量比为 。
(4)该物质中 元素的质量分数最大。
下表是某地区市场上销售的一种“加碘食盐”包装袋上的部分文字说明,请根据此表,结合所学知识,回答下列问题。
| 配料表 |
精制海盐,碘酸钾 |
| 含碘量/kg |
30mg~60mg |
| 包装日期 |
见封底 |
| 储存方法 |
密封、避光、防潮 |
| 食用方法 |
烹调时,待食品熟后加入碘盐 |
(1)根据加碘食盐的储藏方法和食用方法可推测:碘酸钾的化学性质 (填“稳定”或“不稳定”)
(2)碘酸钾的化学式为KIO3,则碘酸钾的相对分子质量为 ,其中碘元素的质量分数为 ,(保留至0.1%)碘元素的化合价为 价.
(3)碘酸钾中碘元素、钾元素、氧元素的质量比为 ;
(4)根据表中数据计算,每500克该加碘食盐中碘酸钾KIO3的质量范围是
A、15~30mg B、25~51mg C、60~120mg
(5)中国营养学会推荐:一个18岁的青年每天摄入碘元素的质量为0.15mg。假设碘的来源仅靠这种加碘食盐,该青年每天至少摄入这种食盐应为 克。
铁元素在人体中具有造血功能,是人体所需的微量元素之一,如图是某品牌补铁片标签上的部分文字说明。回答:
(1)硫酸亚铁(FeSO4)是由___________种元素组成;
(2)一个硫酸亚铁分子中有___________个原子;
(3)FeSO4的相对分子质量为___________;
(4)硫酸亚铁中铁元素质量分数为_________________(保留0.1%);
(5)按照说明书服用补铁片时,成人每天补充铁元素质量为___________mg(保留整数)。
蛋白质在人体胃肠内与水反应,最终生成氨基酸被人体吸收。丙氨酸(化学式为C3H7O2N)就是其中的一种。请回答下列问题:
(1)丙氨酸的相对分子质量是______________
(2)丙氨酸中C、H、O、N各元素质量比为____________
(3)丙氨酸中氮元素的质量分数 (计算结果精确到0.1%)。
了解物质的组成和结构,有助于认识物质的性质。
(1)下图表示核电荷数为11~17的元素最高和最低化合价。
①从图中可以看出,硫元素的最高正价是 。
②若某元素既可显正价,又可显负价,则最高正价与最低负价绝对值的代数和为 。
③写出图中元素的化合价随着核电荷数递增的一条变化规律 。
(2)在金属活动性顺序表里,通常排在前面的金属更易失去电子。回答以下问题:
①某金属原子的结构示意图为 ,则最外层电子数x= ;若最外层电子失去,达到相对稳定结构,该带电粒子的符号为 。
,则最外层电子数x= ;若最外层电子失去,达到相对稳定结构,该带电粒子的符号为 。
②我国古代发明了“曾青(即硫酸铜)得铁化为铜”的湿法炼铜法,请用化学方程式表示反应原理 ;该反应的基本反应类型为 。
用数字和符号填空:
①2个氢原子_________, ②3个硝酸根离子 ,
③氯化亚铁中铁元素的化合价 ,④人体缺 元素易得骨质疏松、佝偻病。
A~F分别是氢气、氧气、氮气、一氧化碳、水、甲烷六种物质中的一种,请回答下列问题。
(1)C中两种元素的质量比为3:1。则C的化学式为_ 。
(2)C与D分别在B中燃烧均能生成F,在一定条件下,A和D反应能生成C和F。请写出下列物质的化学式:A为 ,D为 ,F为 。
(3)根据以上的推断,请写出下列两个反应的化学方程式:
A与D反应: ;
D与B反应: _。
请写出物质E的一种用途: 。
葡萄糖(化学式为C6H12O6)是一种有甜味、易溶于水的白色粉末状固体。葡萄糖在人体内发生缓慢氧化转化为二氧化碳和水,并释放出热量。下面是有关葡萄糖的一些计算。
(1)葡萄糖中各元素的质量比为C:H:O= ;
(2)葡萄糖中各元素的原子个数比为C:H:O= ;
(3)葡萄糖中氢元素的质量分数为 (保留一位小数)
请将下列短文中加点的部分,用恰当的化学符号填写在横线上:
太阳镜具有保护眼睛的功能。它的镜脚一般是由塑料(其中含有碳元素 )制成的,玻璃镜片的主要成分是二氧化硅 ,且变色玻璃中含有银离子 ,铜制镜框使用时间过长会生成铜绿(化学式为:Cu2(OH)2CO3),铜绿中氢氧根离子的化合价显-1价 。
“湖林是个好地方,桑翠湖边渔米乡。四季鲜笋吃不断,高山白茶美名扬。”湖林学校距离福鼎城关大约40公里,这里以山清水秀、空气清新而闻名,这里远离污染、原生态的环境足以让人留连忘返。(共16分)
(1)桑翠湖水属于 (填“纯净物”或“混合物”);要测定桑翠湖水是硬水还是软水,你的做法是 ;在野外野炊时,要降低水的硬度,只要 即可。
(2)你认为会对空气造成污染的有害气体是 (至少填一种)。
(3)桑翠湖水一年四季都很清澈原因是多种的,请说说为防止水源污染,你能做些 。(至少说到一种)
(4)每当秋高气爽时节,这里的方笋就破土而出,采摘回来,剥皮下锅,霎时清香四逸。请用分子的观点来解释“清香四逸” 。
(5)湖林高山白茶是福鼎白茶中的上好品种,叶中的化学成分极其丰富。主要有水分、多酚类化合物、蛋白质、氨基酸、酶、生物碱、糖类、维生素等。其中几大茶类中以福鼎白茶的多酚类化合物含量最高,是其它茶类的2-30倍。因此福鼎白茶的保健功能最好。其中茶多酚的化学式是(C22H18O11),请计算:
①茶多酚的相对分子质量为 。
②每个茶多酚分子中共有 个原子,其中碳、氧原子个数比为 。
③茶多酚中碳元素和氧元素的质量比是 (化为最简整数比)?
(1)用化学用语表示:
①3个氯原子 ;
②2个镁离子 ;
③空气中含量最多的物质 ;
④正5价磷的氧化物化学式是 。
(2)按要求填空:
①Al2O3读作 ;②正2价的钙元素写作 ;③在HNO3中(H为+1价、O为-2价),求N的化合价为 ;④保持二氧化碳化学性质的最小粒子是 。
某兴趣小组在制取氧气的实验过程中,有如下实验设计方案,该方案的实验目的是:探究 对反应速率的影响。
| 编号 |
温度 |
催化剂 |
氯酸钾、二氧化锰的质量比 |
生成1升氧气所需时间/s |
| 实验Ⅰ |
400℃ |
MnO2 |
1:1 |
153 |
| 实验Ⅱ |
400℃ |
MnO2 |
2:1 |
240 |
小芳在实验时,误把氧化铜当作二氧化锰放入加热,结果发现也能较快产生氧气,于是进行如下探究:
【猜想Ⅰ】除二氧化锰、氧化铜外,氧化铁(Fe2O3)也可以作氯酸钾分解的催化剂。
【设计实验】
按下表进行实验,并测定开始产生气体时的温度(提示:开始产生气体的温度越低,表示反应速度越快)。
| 实验编号 |
实验药品 |
分解温度(℃) |
| ① |
氯酸钾 |
580 |
| ② |
氯酸钾和二氧化锰(质量比1︰1) |
350 |
| |
氯酸钾和氧化铜(质量比1︰1) |
370 |
| |
氯酸钾和氧化铁(质量比1︰1) |
390 |
【数据和结论】
(1)由实验 与实验④对比,证明猜想合理;
(2)实验所用的三种物质中,催化效果最好的是 。
【反思】
(1)若要证明氧化铁是该反应的催化剂,还需验证它在化学反应前后的 和 是否改变。
小林在实验时,联想到了渔民用过氧化钙(CaO2)增加鱼池中的含氧量,提出猜想Ⅱ。
【猜想Ⅱ】过氧化钙与水反应可制取氧气。
| 实验装置 |
实验主要过程 |
 |
①检查装置气密性。 ②加入过氧化钙和水后,有少量细小气泡缓慢放出,在导管口几乎收集不到气体。该装置放置到第二天,集气瓶中只收集到极少量气体,震荡试管后仍有少量细小气泡缓慢放出。 |
实验结论:过氧化钙与水反应 (填“能”或“不能”)用于实验室制取氧气。
【分析与反思】
(1)过氧化钙与水反应虽然没有快速收集到大量氧气,但由此实验现象,小林认为渔民用过氧化钙做增氧剂的主要原因是 。
(2)小林希望对此实验进行改进,使该反应加快,请你帮他提出合理化建议 。
(3)同学们对过氧化钙与水反应的生成物猜想如下:①氢氧化钙和氧气②碳酸钙和氧气
你认为猜想 (填序号)一定是错误的,理由是 。
【计算】该兴趣小组的同学们购得用于增氧的过氧化钙产品(杂质不含钙元素),标签如图所示。
试计算:
(1)过氧化钙的相对分子质量为 ;
(2)过氧化钙中钙元素与氧元素的质量比为 ;
(3)过氧化钙中钙元素质量分数为 ;
(4)该产品中过氧化钙的质量分数至少为 。