取一定量氧化铁与氧化铜的混合物,向其中加入50g溶质的质量分数为14.6%的稀盐酸,恰好完全反应生成盐和水,则原混合物中氧元素的质量是
| A.6.4g | B.3.2g | C.1.6g | D.0.8g |
某4.6g有机物完全燃烧得到8.8g CO2和5.4 H2O,可以判断该有机物组成( )
| A.只含有碳、氢两种元素 | B.含碳、氢、氧三种元素 |
| C.含有碳、氢两种元素,可能含有氧元素 | D.无法确定 |
常温下,将160g某粗盐样品(含杂质氯化镁、氯化钙和泥沙)溶解于水中,过滤得到不足3g泥沙和1000g溶液。取出500溶液进行测定,其中含有镁元素1.2g,钙元素2g,氯元素42.6g。则原粗盐中氯化钠的质量分数约为 ( )
| A.73.1% | B.76.3% | C.36.6% | D.31.6% |
实验需要质量分数为20%的稀硫酸。现将50g质量分数为98%的浓硫酸稀释为质量分数为20%的稀硫酸,需要水的质量是
| A.245g | B.195g | C.100g | D.50g |
一定条件下,在一个密闭容器内发生某反应,测得反应前后各物质的质量如下图所示。
下列关于以上反应的说法中,正确的是
| A.X的值为44 | B.W由碳、氢两种元素组成 |
| C.该反应属于置换反应 | D.W中碳、氢元素质量比为4∶1 |
将质量为92g的铁棒插入一定量的硫酸铜溶液中,过一段时间后取出,洗涤干燥称重质量增加到100g,则所得铁棒中铁的质量分数为( )
| A.56% | B.37.5% | C.36% | D.55% |
钯金(Pd)是一种新的首饰。为获得单质钯,取100 g 17.7%的PdCl2溶液,加入10.0 g铁粉使其充分反应,得到钯及其铁的氯化物。经分析所得钯的质量为10.6 g,未反应的铁粉质量为4.4 g。下列说法正确的是
| A.生成铁的氯化物质量为12.7 g | B.生成铁的氯化物质量为95.0 g |
| C.生成铁的氯化物为FeCl2 | D.生成铁的氯化物为FeCl3 |
小华在测定铁在O2中燃烧的产物时,发现5.6g铁在足量的O2中燃烧得到7.8g固体。不考虑称量等误差因素,则该固体产物的组成可能是
| A.Fe3O4和Fe2O3 | B.Fe3O4和FeO | C.Fe3O4和Fe | D.Fe3O4、FeO和Fe |
铁粉、铝粉的混合物5.6g与足量的稀硫酸完全反应,则反应中生成氢气的质量可能为:
| A.0.15g | B.0.30g | C.0.50g | D.0.75g |
碳酸氢钠用于焙制糕点,在270℃时分解:2NaHCO3 Na2CO3+H2O+CO2↑.现取NaHCO316.8g,在敞口容器中加热到质量不再改变为止,减少的质量为( )
Na2CO3+H2O+CO2↑.现取NaHCO316.8g,在敞口容器中加热到质量不再改变为止,减少的质量为( )
| A.4.4g | B.6.2g | C.8.8g | D.10.6g |
一定条件下,在托盘天平的左右两盘上各放一只烧杯,均加入质量分数相同、体积相等的稀盐酸,调整天平呈平衡状态。下列实验操作,最终仍能使天平保持平衡的是
| A.向左、右两烧杯中分别加入5.6 g Fe和1.8 g Al,两种金属完全溶解 |
| B.向左、右两烧杯中分别加入相等质量的Al、Zn,两种金属完全溶解 |
| C.向左、右两烧杯中分别加入相等质量的Fe、CaCO3,反应后盐酸均有剩余 |
| D.向左、右两烧杯中分别加入相等质量的Mg、Al,反应后两种金属均有剩余 |
在已调平的托盘天平两边各放一只等质量的烧杯,在两只烧杯里分别注入200g溶质质量分数为7.3%的稀盐酸,调至天平平衡后,向左边烧杯中加入2.2gFe2O3,要使充分反应后天平仍然保持平衡,需向右边烧杯中加入金属镁的质量为
| A.4.8g | B.2.4g | C.2.2g | D.0.2g |
向一定质量的硫酸铜溶液中加入不同质量的铁粉所呈现的信息如下表:
| Fe质量/g |
5.6 |
11.2 |
16.8 |
22.4 |
| Cu质量/g |
6.4 |
12.8 |
19.2 |
22.4 |
根据信息,下图所示关系正确的是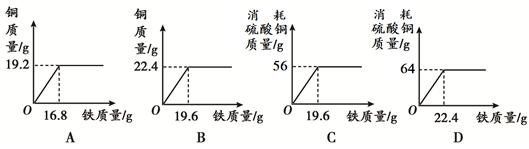
一定量铜粉和镁粉的混合物与足量稀硫酸完全反应,过滤,所得固体不溶物在加热条件下与足量氧气充分反应后,所得产物的质量是原混合物质量的一半,则原混合物中铜粉和镁粉的质量比为 ( )
| A.1∶1 | B.4∶3 | C.2∶3 | D.3∶2 |
碳酸钙在高温条件下发生如下反应:CaCO3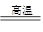 CaO+CO2↑,将100 g含CaCO3质量分数为80 %的石灰石样品(杂质不发生反应,也不含钙元素),高温煅烧一段时间后,冷却,测得剩余固体中含钙元素的质量分数为41%,则生成的CaO的质量约为
CaO+CO2↑,将100 g含CaCO3质量分数为80 %的石灰石样品(杂质不发生反应,也不含钙元素),高温煅烧一段时间后,冷却,测得剩余固体中含钙元素的质量分数为41%,则生成的CaO的质量约为
| A.28.0 g | B.44.8 g |
| C.56.0 g | D.78.0 g |