[江苏]2013届江苏省南京市白下区中考二模化学试卷
下列物质的用途主要与它的物理性质有关的是
| A.一氧化碳用于冶金工业 | B.石墨用作电极 |
| C.熟石灰用于改良酸性土壤 | D.天然气用作燃料 |
材料与人类生活密切相关,下列物品由有机合成材料制成的是



| A.羊毛衫 | B.塑料盆 | C.不锈钢餐具 | D.玻璃杯 |
配制一定溶质质量分数的氯化钠溶液,下列实验操作不正确的是 
| A.氯化钠的取用 | B.氯化钠的称量 | C.水的量取 | D.氯化钠的溶解 |
酒精灯的火焰太小时,将灯芯拨得松散些,可使火焰变旺。其原理是
| A.降低可燃物的着火点 | B.提高可燃物的着火点 |
| C.增加空气中氧气含量 | D.增大可燃物与空气的接触面积 |
下列有关“化学之最”的叙述不正确的是
| A.人体中含量最多的物质是水 | B.相对分子质量最小的气体是氢气 |
| C.地壳中含量最多的金属元素是铁 | D.天然存在的最硬的物质是金刚石 |
根据右图的有关信息判断,下列说法不正确的是
| A.氯原子的核电荷数为17 |
| B.钠的原子结构示意图中X=8 |
| C.氯元素的相对原子质量为35.45 |
| D.在化学反应中,钠原子容易得到1个电子 |
按单质、氧化物、混合物的顺序排列的一组物质是
| A.空气、氧化汞、石灰石 | B.生石灰、红磷、冰水混合物 |
| C.液氮、干冰、乙醇汽油 | D.氦气、熟石灰、可燃冰 |
某化学兴趣小组通过实验验证Ag、Fe、Cu三种金属的活动性顺序,下列所选试剂不可行的是
| A.Cu、Ag、FeSO4溶液 | B.Fe、Ag、CuSO4溶液 |
| C.Fe、Cu、稀盐酸、AgNO3溶液 | D.Cu、FeSO4溶液、AgNO3溶液 |
在水中能大量共存且形成无色溶液的一组离子是
| A.Cu2+、SO42-、H+ | B.NH4+、Cl-、OH- |
| C.Ba2+、SO42-、NO3- | D.Na+、K+、NO3- |
下列物质长期露置于空气中,因发生化学变化而使溶液质量减少的是
| A.浓硫酸 | B.石灰水 | C.浓盐酸 | D.氢氧化钠溶液 |
某化学兴趣小组探究盐酸和氢氧化钠反应过程中溶液pH的变化规律,得到如右图所示曲线。下列有关说法正确的是
| A.该实验是将氢氧化钠溶液滴入盐酸中 |
| B.b点表示盐酸和氢氧化钠恰好完全反应 |
| C.a点时的溶液能使石蕊溶液变红 |
| D.c点时的溶液中,溶质只有氯化钠 |
取一定量氧化铁与氧化铜的混合物,向其中加入50g溶质的质量分数为14.6%的稀盐酸,恰好完全反应生成盐和水,则原混合物中氧元素的质量是
| A.6.4g | B.3.2g | C.1.6g | D.0.8g |
香料化学家已经开发出多种酯类人工香料,如丁酸甲酯(化学式为C5H10O2)具有苹果香味。下列有关丁酸甲酯的说法正确的是
| A.丁酸甲酯属于有机高分子化合物 |
| B.丁酸甲酯的每个分子由17个原子构成 |
| C.丁酸甲酯中氧元素的质量分数约为58.82% |
| D.丁酸甲酯中碳元素、氢元素和氧元素的质量比为30︰5︰16 |
下表列出了除去物质中所含少量杂质的方法,其中不正确的是
| 选项 |
物质 |
所含杂质 |
除去杂质的方法 |
| A. |
N2 |
O2 |
将气体缓缓通过足量的灼热铜网 |
| B. |
NaCl |
KNO3 |
冷却热饱和溶液,过滤 |
| C. |
Cu |
Zn |
加入足量稀盐酸,充分反应后过滤,洗涤,干燥 |
| D. |
FeCl2溶液 |
CuCl2 |
加入足量铁粉,充分反应后过滤 |
如图所示装置(气密性良好),若先将甲中液体挤出,观察到气球明显鼓起,一段时间后恢复原状;再将乙中液体挤出,气球又明显鼓起。下列组合正确的是
| 选项 |
滴管甲 |
烧杯丙 |
滴管乙 |
烧杯丁 |
| A. |
双氧水 |
二氧化锰 |
水 |
氢氧化钠 |
| B. |
盐酸 |
镁 |
盐酸 |
碳酸钠 |
| C. |
水 |
氢氧化钠 |
水 |
硝酸铵 |
| D. |
水 |
氧化钙 |
盐酸 |
镁 |
下表是NaCl、KNO3在不同温度时的溶解度:
| 温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
|
| 溶解度/g |
NaCl |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
| KNO3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
据此数据判断,下列说法不正确的是
A.NaCl和KNO3的溶解度曲线在20~30℃温度范围内会相交
B.在40℃时,100g NaCl饱和溶液中的溶剂质量大于100gKNO3饱和溶液中的溶剂质量
C.在50℃时,NaCl和KNO3各30g分别加入两只各盛有50g水的烧杯中,均不能形成饱和溶液
D.在60℃时,向52.5g KNO3饱和溶液中加入47.5g水,溶液中溶质的质量分数为27.5%
下列各组物质间通过一步反应就能实现如图转化 ,则甲、乙、丙可能的组合是
,则甲、乙、丙可能的组合是
| 选项 |
甲 |
乙 |
丙 |
| A. |
C |
CO2 |
CO |
| B. |
CuO |
CuCl2 |
Cu(OH)2 |
| C. |
NaOH |
NaCl |
NaNO3 |
| D. |
H2O2 |
H2O |
O2 |
根据下列装置图,回答有关问题: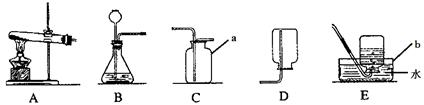
(1)写出装置中标号仪器的名称:a ,b 。
(2)实验室制取氧气时选用A作为发生装置,若试管中是混有二氧化锰的氯酸钾,该反应的化学方程式为 ;若试管中是高锰酸钾,则需要在试管口放一团棉花,其目的是 。
(3)实验室制取二氧化碳时选用B作为发生装置,该反应的化学方程式为 ;选用C作为收集装置,则检验二氧化碳是否已收集满的方法是 。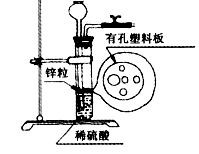
(4)实验室用锌粒与稀硫酸反应制取氢气,发生装置如右图所示。打开止水夹,若发现稀硫酸未能与有孔塑料板上的锌粒接触,但此时已无稀硫酸可加,则下列溶液中,最适宜从长颈漏斗中添加的是 (选填字母)。
| A.氢氧化钠溶液 | B.碳酸钠溶液 |
| C.硫酸钠溶液 | D.澄清石灰水 |
构建知识网络是一种重要的学习方法。右图是有关铁的性质和获得的网络图。
(1)反应①的化学方程式为 。
(2)右图所示的六个反应中,一定属于置换反应的是 (选填序号)
(3)反应④可以通过铁制品锈蚀来实现(铁锈的主要成分是Fe2O3·xH2O),铁制品的锈蚀过程实际上是铁与 发生化学反应的过程。
(4)铜制品在空气中也会发生锈蚀[铜锈的主要成分是Cu2(OH)2CO3]。
①根据铜锈的主要成分中含有氢元素,可以判断出铜生锈需要空气中的 ;根据铜锈的主要成分中含有碳元素,可以判断出铜生锈需要空气中的 。
②某化学兴趣小组欲通过实验探究“铜生锈是否需要空气中的氧气?”下图所示实验中(试管内的“ ”均为铜片),只需完成实验 和 即可达到探究目的(选填字母)。
”均为铜片),只需完成实验 和 即可达到探究目的(选填字母)。
钠的化合物在日常生活中应用广泛。
(1)氢氧化钠溶液可用于鸡舍消毒,氢氧化钠的俗名是 (写一种)。
(2)次氯酸钠(NaClO)是84消毒液的有效成分,次氯酸钠中氯元素的化合价为 。
(3)碳酸氢钠是发酵粉的主要成分,碳酸氢钠与盐酸反应的化学方程式为 。
(4)氯化钠是重要的调味品,下图1、2分别表示不同的化学反应,但生成物中都有氯化钠。

图1 图2
①图1是钠与氯气反应生成氯化钠的示意图,氯化钠是由 (选填“原子”、“分子”或“离子”)构成的;元素的化学性质与其原子的核外电子排布,特别是 的数目有关。
②图2描述了氢氧化钠溶液与盐酸反应的微观实质,该反应所属基本反应类型为
反应;图中A、B、C处应填入的化学符号依次为 。
化学与能源开发、环境保护、生产生活等密切相关。
(1)煤、 和天然气是常见的化石燃料。随着全球能源使用量的不断增长,人类正在利用和开发新能源,如潮汐能、核能、 等(写一种)。
(2)明矾可用于净水,是因为明矾溶于水生成的胶状物可以 悬浮于水中的杂质,使之从水中沉降出来。2013年4月20日,四川省雅安市芦山县发生7.0级地震,为防止震后疾病传染,必须对饮用水进行处理,采取的措施有:①煮沸、②消毒、③过滤、④自然沉降,最合理的处理顺序是 (选填字母)。
| A.③①②④ | B.④②③① | C.④①③② | D.④③②① |
(3)缺锌者可在医生指导下通过服用葡萄糖酸锌口服液来补锌,锌属于 元素(选填“常量”或“微量”)。基本营养素中, 是构成细胞的基本物质,是机体生长和修补受损组织的主要原料。
(4)汽车尾气催化转换器中发生的反应可减少有害气体排放,其反应过程的微观变化如下图:
该反应的化学方程式为 ,生成的C与D的质量比是 (用最简整数比表示)。
右图是初中化学中常见物质间的转化关系。常温下,A、B、E为气体,C、D为液体;A、B能产生温室效应,D、E是人类生命活动的必需物质。图中“—”表示两端的物质能发生化学反应,“→”表示物质间存在转化关系,反应条件、部分反应物和生成物已略去。
(1)写出D→E的化学方程式: 。
(2)写出A→B的化学方程式: 。
(3)写出B物质的一种用途: 。
(4)若23g C与足量E发生反应,生成44gB和27g D,则C的化学式为 。
MnO2是一种重要的无机功能材料。已知粗MnO2中含有少量MnCO3,某化学兴趣小组在实验室中模拟提纯粗MnO2的工业流程(如下图所示)。
(1)操作A和操作B的名称是 。
(2)蒸发所需的仪器有铁架台(带铁圈)、蒸发皿、酒精灯和 ,所填写的仪器在蒸发过程中的主要作用是 。
(3)写出加稀H2SO4时产生CO2的化学方程式: 。
(4)该流程中可以循环利用的物质是H2SO4和 。
(5)最终所得的MnO2质量 粗MnO2样品中的MnO2质量(选填“>”、“=”或“<”)。
在金属活动性顺序里,钠位于铜之前。某化学兴趣小组发现,将钠投入硫酸铜溶液中,产生无色气体和蓝色沉淀,却未置换出红色的铜。该小组同学对此现象进行了如下探究:
【查阅资料】钠的化学性质非常活泼,常温下就能被空气中的氧气氧化,且能与水迅速反应。
【分析与讨论】
(1)在实验室中通常将钠保存在煤油里,煤油的作用是 。
(2)已知:在一个化学反应中,如果有元素化合价的升高,同时就有元素化合价降低。对于钠与水反应的生成物,甲同学猜想是NaOH和H2,乙同学猜想是NaOH和O2,你认为 同学的猜想不合理,请从化合价的角度解释原因: 。
【进行实验】该小组同学通过实验验证钠与水反应的产物,装置如下图:
注:煤油的密度为0.8g/mL,与水不互溶。
| |
实验操作 |
实验现象及分析 |
| ① |
打开止水夹a及分液漏斗活塞,待液体充满大试管后,关闭止水夹a及分液漏斗活塞。 |
实验现象为:液体分层,钠熔成银白色小球,在液体分层的界面上跳动,产生大量气泡,下层液体逐渐被压入B中。 钠的物理性质有: (任写两条)。 |
| ② |
打开止水夹b,待B中部分液体进入C中,迅速关闭止水夹b。 |
发生反应的化学方程式为: 。 |
| ③ |
打开止水夹c。 |
实验现象为:D中液体 ,C中产生气泡。 |
| ④ |
打开止水夹a,通过分液漏斗向大试管中逐滴加水,将燃着的木条伸至装置左端尖嘴导管口。 |
实验现象为:气体燃烧,产生 色火焰。 |
| ⑤ |
在火焰上方罩一个干冷的烧杯。 |
实验现象为:烧杯内壁出现 。 |
【解释与结论】将钠投入硫酸铜溶液中,产生无色气体和蓝色沉淀,写出发生反应的化学方程式(分两步写): , 。
将过量的Na2CO3溶液滴入到一定量CuSO4溶液中得到蓝色固体。某化学兴趣小组对蓝色固体的成分进行了定性探究,得知其为Cu(OH)2和CuCO3的混合物。
(1)蓝色固体中含有CuCO3,原因是: (用化学方程式表示);蓝色固体中含有Cu(OH)2,原因是:Na2CO3溶液呈 性(选填“酸”、“中”或“碱”)。
(2)已知:Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为200℃~220℃,且各生成对应的两种氧化物。设蓝色固体的组成为aCu(OH)2•bCuCO3,该小组同学用热分析仪对固体进行热分解,获得相关数据,绘成固体质量变化与分解温度的关系如右图。
①写出CD段发生反应的化学方程式:
。
②根据右图计算出a︰b的值。(写出计算过程,计算结果用最简整数比表示)
③D点对应纵坐标的值为 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号