二氧化氯(ClO 2)常用于自来水消毒,工业制取原理为:2NaClO 3+4HCl(浓)═2ClO 2↑+2NaCl+Cl 2↑+2H 2O。某工厂将30kg NaClO 3固体加到100kg浓盐酸中,反应一段时间后,生成13.5kg ClO 2(生成的气体全部逸出,其它物质全部形成溶液)。
已知:NaClO 3和ClO 2的相对分子质量分别为106.5和67.5。
试计算:
(1)NaClO 3中钠元素和氧元素的质量比为 。
(2)参加反应的NaClO 3的质量。
(3)所得溶液中NaClO 3的质量分数(计算结果精确到1%)
人体所需的维生素C(化学式为C 6H 8O 6)主要从蔬菜、水果中摄取,计算:
(1)维生素C中碳、氢、氧三种元素质量的最简整数比为 。
(2)现有溶质质量分数为1%的维生素C的溶液300g,若配制成溶质质量分数为0.3%的维生素C的溶液,问需要加水的质量是多少。(写出计算过程)
我市覃塘区石灰石资源丰富,某石灰厂为了测定某石灰石样品中CaCO3的质量分数,往盛有300g稀盐酸的烧杯中依次加入粉碎后的石灰石样品(杂质不与盐酸反应),充分反应后,实验数据记录如表:
实验次数 |
第一次 |
第二次 |
第三次 |
石灰石样品/g |
25 |
15 |
10 |
烧杯中物质总质量/g |
316.2 |
326.8 |
m |
请回答:
(1)CaCO3中钙、碳、氧三种元素的质量比为 ;(写最简比)
(2)表中m= ;
(3)所用稀盐酸的溶质质量分数为 ;
(4)求该石灰石样品中CaCO3的质量分数。(写出计算过程)
造纸是我国古代四大发明之一,它极大地推动了人类文明的发展。
(1)践行“习近平生态文明思想”,应积极推广垃圾分类和回收利用。旧报纸应投放到贴有如图 (填字母)标签的垃圾筒内。

(2)为增强纸张的耐磨性,可用玉米淀粉对纸张进行施胶处理。玉米淀粉[(C6H10O5)n,n为正整数]中H、O两种元素的质量比为 (用最简整数比表示)。
(3)造纸会产生大量含NaOH的废水,需处理至中性后排放。环保监测小组取某造纸厂废水样品过滤,为测定滤液中NaOH的质量分数,进行了如下实验:
步骤1:取20.0g滤液于锥形瓶中,滴入几滴酚酞溶液。
步骤2:向锥形瓶中逐滴滴加溶质质量分数为10.0%的硫酸溶液至溶液呈中性,此时溶液呈 色。消耗硫酸溶液3.92g。
计算废水滤液中NaOH的质量分数。(请写出计算过程)
铁及其化合物在生产生活中有广泛的应用。
(一)铁的应用和防护
(1)某麦片中含微量铁粉,食用后铁粉与胃酸反应转化为人体可吸收的铁元素,反应的化学方程式为 。
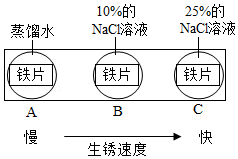
(2)铁锈主要成分是Fe 2O 3•nH 2O,铁生锈主要与空气中的 有关。
(3)如图实验说明NaCl在铁生锈中的作用是 。
(4)铁生锈的次要过程:Fe 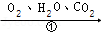 FeCO 3•nH 2O
FeCO 3•nH 2O  FeCO 3
FeCO 3
写出Fe转化为总反应的化学方程式 。
(5)为防止铁生锈,可对铁制品进行"发蓝"处理,使其表面生成致密氧化物(其中Fe、O元素质量比为21:8)保护膜,该氧化物的化学式为 。
(二)废铁的再利用
黄钠铁矾[NaFe x(SO 4) y(OH) z]是一种高效净水剂。用废铁屑(主要成分为Fe,含少量Fe 2O 3和FeCO 3)制备黄钠铁矾的主要流程如图:
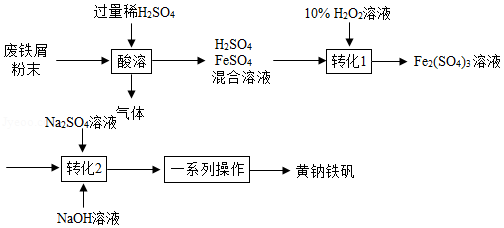
(1)将废铁屑研磨成粉末的目的是 。
(2)"酸溶"时H 2SO 4与Fe、FeCO 3反应,还发生反应的化学方程式有 和Fe+Fe 2(SO 4) 3=3FeSO 4。
(3)"转化1"发生反应的化学方程式为 。反应时温度不宜过高的原因是 。
(三)黄钠铁矾组成确定
称取9.70g黄钠铁矾,用如图装置进行热分解实验。
【资料】
①NaFe x(SO 4) y(OH) z在T 1℃分解会生成H 2O(气态),提高温度至T 2℃继续分解产生SO 3气体,并得到Fe 2O 3和Na 2SO 4。
②浓硫酸可用于吸收SO 3。
(1)装配好实验装置后,先要 。
(2)分别控制温度在T 1℃、T 2℃对A中固体加热。
①控制温度在T 1℃加热,实验后测得B装置质量增加1.08g。
②用D装置替换B装置,控制温度在T 2℃,加热至反应完全。
③T 1℃、T 2℃时,加热后均通入一段时间N 2,目的是 。
(3)反应完全后,将A装置中固体溶于足量水,过滤、洗涤、烘干得4.80g固体,将滤液蒸干得1.42g固体(不含结晶水)。
结论:NaFe x(SO 4) y(OH) z中,x:y:z= 。
反思:若该实验过程中缺少C装置,则x:z的值 (选填"偏大""偏小"或"不变")。
高铁酸钠(Na 2FeO 4)是一种高效多功能水处理剂,工业上常采用次氯酸钠(NaClO)氧化法生产,反应原理用化学方程式表示为:3NaClO+2Fe(NO 3) 3+10NaOH=2Na 2FeO 4↓+3NaCl+6NaNO 3+5H 2O
(1)次氯酸钠(NaClO) 中Cl元素的化合价为 ;
(2)高铁酸钠(Na 2FeO 4)中铁元素和氧元素的质量比为 (填最简比);
(3)现要制得830kg含杂质20%的高铁酸钠,至少需要次氯酸钠的质量是多少?(列式计算)
AgNO3可用于电影胶片制作。现取含有NaNO3的AgNO3样品100g,在一定条件下让样品充分反应,只有AgNO3发生反应,得到固体69g,该过程中发生反应的化学方程式为:2AgNO3 2Ag+2NO2↑+O2↑.试计算:
2Ag+2NO2↑+O2↑.试计算:
(1)AgNO3中N、O元素的质量比为 。
(2)分解产生的混合气体中O2的质量。
(3)另取100该样品和一定质量的NaCl固体全部溶解于142.5g水中,得到含一种溶质的溶液,该溶液溶质的质量分数是多少?
合成氨工业中,常用碳酸钾溶液吸收产生的二氧化碳得到碳酸氢钾,反应的化学方程式为:K2CO3+CO2+H2O═2KHCO3.现向碳酸钾溶液通入二氧化碳,恰好完全反应,得到溶质的质量分数为10%的溶液50g,试计算。
(1)碳酸钾中钾元素、碳元素、氧元素的质量比为 。
(2)若把该50g该溶液,稀释为溶质的质量分数为4%的溶液,需要加入水的质量。
(3)原碳酸钾溶液中溶质的质量分数(计算结果精确到0.1%)。
醋的主要成分是醋酸,其化学式为CH3COOH,醋不仅是调味品,而且还有较强的灭菌、抑毒的作用。

小明为判断家中的米醋含酸量是否合格,取100mL米醋(见标签)于锥形瓶中,然后再向锥形瓶中逐渐加入一定溶质质量分数的碳酸氢钠溶液,反应过程中,当加入碳酸氢钠溶液的质量至以下数值时,对充分反应后锥形瓶中剩余物质的质量进行了记录,测得的部分数据如下,请根据有关信息回答问题(提示:化学方程式为:CH3COOH+NaHCO3═CH3COONa+H2O+CO2↑)
加入碳酸氢钠溶液质量(g) |
25 |
50 |
100 |
155 |
175 |
锥形瓶内剩余物质质量(g) |
123.9 |
147.8 |
195.6 |
248.4 |
m |
(1)醋酸中碳、氢、氧三种元素的质量比为 。
(2)100mL米醋与足量碳酸氢钠溶液反应产生的二氧化碳质量为 g,表中m的数值为 。
(3)请通过计算判断该产品含酸量是否合格?(写出计算过程)
根据如图所示的实验过程和所提供的数据计算(假设恰好完全反应)。

(反应的化学方程式为:K2CO3+CaCl2 ═CaCO3↓+2KCl)
(1)CaCl2中钙元素和氯元素的质量比为 。
(2)样品中碳酸钾的质量分数(写出计算过程)。
(3)反应后所得溶液中氯化钾的质量(写出计算过程)。
某治疗胃酸过多的药片主要成分为碳酸氢钠.为测定药片中碳酸氢钠的含量,将药片研碎,取4.0g样品加热到质量不再减少时,收集到的气体经干燥后质量为0.88g.(碳酸氢钠受热分解的化学方程式:2NaHCO 3 Na 2CO 3+H 2O+CO 2↑,样品中其他成分受热不分解)
(1)碳酸钠中钠、碳、氧三种元素的质量比是 (最简整数比);
(2)计算该样品中碳酸氢钠的质量分数.
2018年2月《自然》杂志上发表了一项新研究,展示了一种全新的加工木材的方法(如图),把天然木材放在NaOH和Na 2SO 3的混合液中煮沸以除去部分木质素,接着在100℃以上的高温中进行机械压缩制成致密木材。
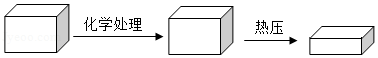
(1)致密木材是由天然木材加工而成的,其密度为天然木材的3倍。
①加工致密木材的材料主要取自于植物的 (填植物器官名称)。
②充分压缩后木材的厚度减小到原天然木材的20%,这一过程主要是 变化。若在压缩过程中底面保持不变,则说明处理过程中木材的质量减少了 (用百分数表示)。
(2)致密木材的硬度、拉伸强度都很大,为天然木材的10倍左右,甚至超过了部分金属。
①致密木材的拉伸强度和纤维素有关。纤维素的化学式为(C 12H 10O 5)n,则其中三种元素的质量比是C:H:O= 。
②拉伸强度  ,它用来表示材料的坚韧程度。拉伸强度与我们所学的科学量 的单位是相同的。
,它用来表示材料的坚韧程度。拉伸强度与我们所学的科学量 的单位是相同的。
(3)与其他材料相比,致密木材的优点是 。
A.加工过程中没有任何污染
B.可代替部分金属材料,具有广阔的应用前景
C.原料来源丰富,能通过无限制砍伐树木加工制成
2018年2月《自然》杂志上发表了一项新研究,展示了一种全新的加工木材的方法(如图),把天然木材放在NaOH和Na 2SO 3的混合液中煮沸以除去部分木质素,接着在100℃以上的高温中进行机械压缩制成致密木材。
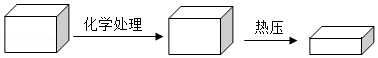
(1)致密木材是由天然木材加工而成的,其密度为天然木材的3倍。
①加工致密木材的材料主要取自于植物的 (填植物器官名称)。
②充分压缩后木材的厚度减小到原天然木材的20%,这一过程主要是 变化。若在压缩过程中底面保持不变,则说明处理过程中木材的质量减少了 (用百分数表示)。
(2)致密木材的硬度、拉伸强度都很大,为天然木材的10倍左右,甚至超过了部分金属。
①致密木材的拉伸强度和纤维素有关。纤维素的化学式为(C 12H 10O 5)n,则其中三种元素的质量比是C:H:O= 。
②拉伸强度= ,它用来表示材料的坚韧程度。拉伸强度与我们所学的科学量 的单位是相同的。
(3)与其他材料相比,致密木材的优点是 。
A.加工过程中没有任何污染
B.可代替部分金属材料,具有广阔的应用前景
C.原料来源丰富,能通过无限制砍伐树木加工制成
今年5月,运用"蓝鲸一号"钻探平台,我国南海神狐海域首次实现可燃冰试采成功.
材料一:可燃冰、学名天然气水化合物,其化学式为CH 4•8H 2O.它是天然气的固体状态(因海底高压).埋于海底地层深处的大量有机质在细菌的分解作用下,最后形成石油和天然气(石油气),其中许多天然气被包进水分子中,在海底的低温(2~5℃)与压力下结晶,形成"可燃冰".
材料二:"蓝鲸一号"钻探平台设计和建造过程刷新了多项世界纪录,它长117米,宽92.7米,高118米,质量为42000吨.
请根据上述材料回答:
(1)形成可燃冰需要一定的生态环境.
①海底地层深处,这些分解有机质的细菌能很好的生存,体现了生物对环境的 .这些细菌分解有机质 (选填"需要"或"不需要")氧气,这些细菌与真菌在细胞结构上的主要区别是 .
②在开采过程中,极少量的垃圾废弃物没有对海洋环境造成破坏,这主要是因为海洋生态系统有 的能力.
(2)形成可燃冰的其中一个条件是有甲烷气源.
①可燃冰(CH 4•8H 2O)中C:H:O的元素质量比是 ,甲烷属于 (选填"有机物"或"无机物").
②与石油、煤等化石燃料相比较,开采可燃冰的积极意义有(写一条) .(可燃冰在空气中燃烧的化学方程式为CH 4•8H 2O+2O 2  CO 2+10H 2O)
CO 2+10H 2O)
(3)如果南海海水的密度是1.03×10 3千克/米 3,"蓝鲸一号"钻探平台漂浮海面受到海水浮力是 牛,浸入海水的体积至少需要 米 3,开采出的可燃冰可以直接在管口点燃,说明已经成为气体,从固体变成气体的原因可能是 .
维生素C主要存在于蔬菜、水果中,其分子式为C 6H 8O 6,在空气中易氧化变质.
(1)维生素C中C、H、O三种元素的质量比为 (用最简比表示).
(2)为测定某鲜榨橙汁中维生素C的含量,兴趣小组进行如下实验:
步骤1 取橙汁样品,加入活性炭,振荡、静置、过滤,滤液移至小烧杯中,盖上玻
璃片.
步骤2 配制碘(I 2)溶液,测得其浓度为1.27g/L(即1升碘溶液中含有1.27克I 2).
步骤3 快速移取20.00mL处理后的橙汁样品置于锥形瓶中,滴入碘溶液,恰好完全反应时消耗碘溶液10.00mL.(测定原理:C 6H 8O 6+I 2═C 6H 6O 6+2HI)
①步骤1中活性炭的作用是 .
②步骤3必须在步骤1、步骤2之后立即进行的原因是 .
③计算1L该橙汁样品中含有维生素C的质量: g.(请写出计算过程)