以FeSO4•7H2O为原料制备铁红(Fe2O3)的一种方法如图:

已知“沉淀”时的主要反应为:2FeSO4+H2O2+2H2O═2FeO(OH)↓+2H2SO4
(1)FeO(OH)中铁元素的化合价为 。FeO(OH)可表示为mFe2O3•nFe(OH)3, 。
(2)“沉淀”时需控制溶液的pH与反应的温度。
①“沉淀”时调节溶液的初始pH约为4,过程中应始终保持溶液的pH为3.0~4.5,需不断加入物质Z调节溶液的pH,Z应具备的性质有 (填字母)。
A.能与酸反应
B.能与碱反应
C.不与FeO(OH)反应
②“沉淀”时反应温度不宜过高,其原因是 。
(3)“过滤”后需对固体进行洗涤与干燥。洗涤时被除去的沾于固体表面的阴离子为 (填离子符号)。
(4)“煅烧”时反应的化学方程式为 。
(5)如图为其他条件相同时不同煅烧温度对产品中Fe2O3质量分数的影响。煅烧温度较低时,产品中Fe2O3质量分数较低,其原因是 。当煅烧温度达800℃时,继续升高温度,产品中Fe2O3质量分数降低,且铁元素质量分数升高,所得产品发黑,其可能原因是 。

(6)用该方法制备Fe2O3,计算理论上13.9t FeSO4•7H2O(相对分子质量为278)可制得Fe2O3的质量(写出计算过程)。
CO2是最主要的温室气体,也是巨大的碳资源,CO2的低能耗捕集、转化和利用正受到世界各国的广泛关注。
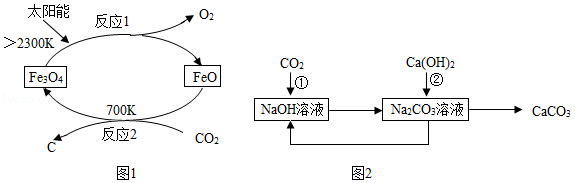
(1)以CO2为原料制取炭黑的太阳能工艺如图1所示。
①反应1的基本类型为 。
②反应2中碳元素的化合价 (填“升高”“不变”或“降低”)。
(2)利用NaOH溶液吸收CO2,部分转化关系见图2。
反应①的化学方程式为 ,该转化中循环使用的物质是 。
(3)利用Na2CO3或K2CO3溶液吸收低浓度的CO2,将其转化为NaHCO3或KHCO3,NaHCO3或KHCO3受热分解生成高浓度的CO2储存利用,生成的Na2CO3或K2CO3循环使用以降低生产成本。
吸收剂 |
Na2CO3 |
K2CO3 |
20℃最高浓度(g/L) |
212 |
1104 |
价格(元/Kg) |
1.25 |
9.80 |
根据表中信息,选择K2CO3溶液作吸收液的优点是 。
(4)利用一种新型“人造树叶”将CO2转化为乙醇(C2H5OH)的反应如下:2CO2+3H2O C2H5OH+3O2,研究显示,1L“人造树叶”每天能从空气中吸收968g CO2,计算1L“人造树叶”工作1天可得到乙醇的质量(写出计算过程)。
(5)某研究小组设计如图3所示实验,探究CO2和H2在一定条件下反应的产物。
查阅资料:①CO2和H2在合适催化剂和一定温度下反应转化为CO和H2O;
②白色无水硫酸铜吸水后变为蓝色。
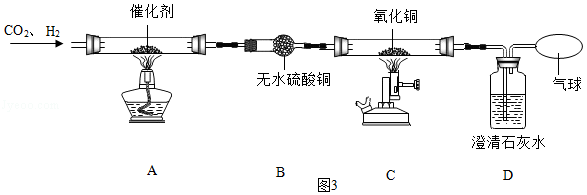
实验过程中观察到的主要现象有:B装置中白色固体变为蓝色,C装置中黑色固体变为红色,D装置中澄清石灰水变浑浊。
①设计B装置的目的是 。
②C装置中发生的反应的化学方程式为 。
③研究小组反思后认为,根据上述实验现象不能确认CO2和H2反应生成了CO,理由是 。
我国拥有地球上7%的耕地,但化肥使用量却占全球总量的35%,认识化肥,科学施肥至关重要。
(1)下列物质中,可用作磷肥的是 :
A.K 2SO 4 B.CO(NH 2) 2 C.KNO 3 D.Ca(H 2PO 4) 2
(2)NH 4Cl是常见的氮肥,不能与碱性物质混用,否则会因释放出 而损失肥效;
(3)过度使用化肥造成的后果有:① ;②水体富营养化等;
(4)"雷雨发庄稼"现象涉及的化学反应较为复杂,其中一个反应是NO 2与H 2O反应生成HNO 3和NO,写出该反应的化学方程式: ;该反应中。化合价发生改变的元素是_ (填元素符号)。
高铁酸钠(Na 2FeO 4)是一种高效多功能水处理剂,工业上常采用次氯酸钠(NaClO)氧化法生产,反应原理用化学方程式表示为:3NaClO+2Fe(NO 3) 3+10NaOH=2Na 2FeO 4↓+3NaCl+6NaNO 3+5H 2O
(1)次氯酸钠(NaClO) 中Cl元素的化合价为 ;
(2)高铁酸钠(Na 2FeO 4)中铁元素和氧元素的质量比为 (填最简比);
(3)现要制得830kg含杂质20%的高铁酸钠,至少需要次氯酸钠的质量是多少?(列式计算)
新冠疫情发生以来,在“坚定信心、同舟共济、科学防治、精准施策”的思想指引下,中国抗疫取得重大胜利!
(1)对新型冠状病毒的毒株分离和基因测序,是研发疫苗和药物的基础。为应对疫情,同学们都居家学习,在此期间做法合理的有 。
A.健康饮食,平衡膳食
B.长时间躺床上看书
C.多服用抗生素增强抵抗力
D.关爱家人,乐观面对生活
(2)佩戴口罩出行是预防新冠肺炎的重要举措。一次性口罩需要及时更换,废弃的口罩应放入 垃圾桶最合适。
(3)对公共场所的定期消毒是控制新冠肺炎的有力保障。“84”消毒液被广泛用于新冠疫情的卫生消毒,可通过氯气与氢氧化钠反应制取,生成物中有氯化钠、次氯酸钠(NaClO) 和水,其中次氯酸钠是消毒液的有效成分。
①次氯酸钠中氯元素的化合价为 。
②写出制取“84”消毒液的化学方程式 。

高锰酸钾是一种重要的化工产品,在化学、生产、生活等场境中都有重要的用途。某工厂生产高锰酸钾的流程如图所示。
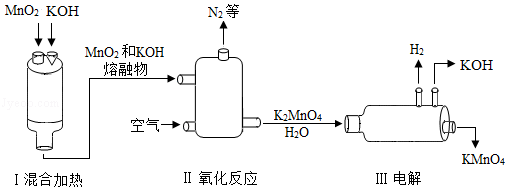
请回答下列问题:
(1)写出高锰酸钾的一种用途 。
(2)“Ⅰ混合加热”发生的主要是 (填“物理”或“化学”)变化。
(3)请将“Ⅱ氧化反应”发生反应的化学方程式补充完整(在横线上填化学式)。
(4)“Ⅲ电解”反应中,反应前后化合价发生变化的元素有 (写元素符号)。
(5)生产流程中可循环利用的物质是 (写化学式)。
随着手机、电脑等移动设备的普及,人们对充电设备的要求越来越高。最近,某品牌氮化镓充电设备以体积小、功率大深受消费者喜爱。
(1)氮化镓(GaN)是充电设备中的核心材料。查阅资料得知:氮化镓中氮元素的化合价与氨气(NH3)中氮元素的化合价相同。由此可知,氮化镓中镓元素的化合价为 。
(2)氮化镓的制取可通过镓与氨气在高温下发生置换反应来实现,其反应的化学方程式为 。
饮水安全是脱贫攻坚“两不愁、三保障、安全”的重要内容和指标,关乎百姓生命健康,必须对天然水进行净化达标后才能饮用。
(1)在净化水的过程中常用 来吸附水中的色素和异味,用二氧化氯(ClO2)消毒杀菌,二氧化氯中氯元素的化合价为 。
(2)某同学在使用“除垢剂”去除热水瓶中的水垢时,发现有气泡产生。根据水垢的主要成分含有碳酸钙等物质,猜想到“除垢剂”的有效成分中可能含有酸。于是,他分别设计了在家庭中和实验室用两类不同物质且产生两种不同现象的实验方案验证自己的猜想,请完成实验报告。
实验步骤 |
实验现象 |
实验结论 |
家庭中:取适量“除垢剂”于瓷碗中,向其中加入 。 |
|
“除垢剂”的有效成分中一定含有酸。 |
实验室:取适量“除垢剂”于试管中,向其中加入 。 |
|
根据实验结论,得出使用“除垢剂”时的注意事项有 (写一条)。
随着手机、电脑等移动设备的普及,人们对充电设备的要求越来越高。最近,某品牌氮化镓充电设备以体积小、功率大深受消费者喜爱。
(1)氮化镓(GaN)是充电设备中的核心材料。查阅资料得知:氮化镓中氮元素的化合价与氨气(NH3)中氮元素的化合价相同。由此可知,氮化镓中镓元素的化合价为 。
(2)氮化镓的制取可通过镓与氨气在高温下发生置换反应来实现,其反应的化学方程式为 。
过氧化氢(H2O2)既是工业上重要的氧化剂,又是常用的医药消毒剂。
(1)H2O2中氧元素的化合价是 价,其中氢氧两种元素的质量比为 ,
(2)某过氧化氢的水溶液中,溶质与溶剂的质量比为1:4,该溶液中溶质的质量分数为 ,100克该溶液中氧元素质量为 克。(精确到0.1克)
废旧电路板中主要含有塑料、铜和锡(Sn)等,为实现对锡的绿色回收,设计如下工艺流程:
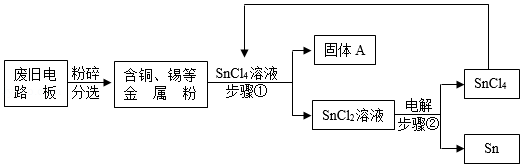
已知:Sn+SnCl4═2SnCl2
(1)塑料属于 (填“有机物”或“无机物”)。
(2)SnCl2中锡元素的化合价是 。
(3)铜的金属活动性比锡的 (填“强”或“弱”);固体A中一定含有的金属元素是 。
(4)写出步骤②发生反应的化学方程式 ,其反应类型是 。
(5)相比于直接焚烧废旧电路板回收金属,该工艺的主要优点是 (回答一点)。
随着手机、电脑等移动设备的普及,人们对充电设备的要求越来越高。最近,某品牌氮化镓充电设备以体积小、功率大深受消费者喜爱。
(1)氮化镓(GaN)是充电设备中的核心材料。查阅资料得知:氮化镓中氮元素的化合价与氨气(NH3)中氮元素的化合价相同。由此可知,氮化镓中镓元素的化合价为 。
(2)氮化镓的制取可通过镓与氨气在高温下发生置换反应来实现,其反应的化学方程式为 。
2019 年 5 月 18 日电,国内首台 80 吨液氧甲烷火箭发动机﹣﹣“天鹊”发动机(TQ﹣12)日前试车成功,这意味着我国民营航天力量首次掌握了百吨级液体火箭发 动机关键技术并具备发动机研制所需的保障能力。试回答下列问题:
(1)“液氧”是 。(填“纯净物”或“混合物”)
(2)写出甲烷燃烧的化学方程式 。
(3)Na2O2 作供氧剂发生如下反应:2Na2O2+2H2O=4NaOH+O2↑,Na2O2中氧元素的化合价是 ;CaO2与水发生类似反应,请填写下列方程式空白处物质 的化学式:CaO2+H2O→ +O2↑(未配平)
(4)工业上采用分离液态空气获得氧气,此方法是 。(填“物理变化”或“化学变化”)
(5)氧气的用途很广,请说出一例氧气的用途 。
氕、氘、氚是氢的三种同位素原子,它们的原子结构模型如图所示,相关信息如表。试回答
名称 |
符号 |
相对原子质量 |
氕 |
H |
1 |
氘 |
D |
2 |
氚 |
T |
3 |
(1)原子结构模型中的“⊗”表示的粒子是 。
(2)超重水有一定的放射性。一个超重水分子由两个原子和一个氧原子构成,其化学式可表示为T2O,T2O中T的化合价为 。
(3)重水是由氘和氧组成的化合物,化学式可表示为D2O,重水和普通水化学性质相似。在海水中重水的质量约占0.02%,则100吨海水中所含氘的质量是多少?
84消毒液是一种无色或者淡黄色具有刺激性气味的含氯消毒剂,有效成分为次氯酸钠(NaClO)。广泛用于医院、宾馆、旅游、家庭等的卫生消毒。某化学兴趣小组对该消毒液进行了如下系列探究。
【查阅资料】
Ⅰ84消毒液不稳定,其杀菌作用主要依靠有效氯,有效氯越高杀菌效果越好。
Ⅱ消毒杀菌就是使病毒蛋白质变性,鸡蛋中蛋白质发生变性反应时变成白色固体。
探究一:84消毒液中有效氯含量的稳定性
0.5%的84消毒液在不同温度、不同存放时间下的有效氯含量:
| 存放时间 (小时) |
不同温度下,有效氯存留率 |
|
|
|
| 60℃ |
70℃ |
80℃ |
90℃ |
|
| 0(对照) |
100% |
100% |
100% |
100% |
| 3.0 |
…… |
…… |
94.66% |
88.05% |
| 6.0 |
…… |
96.66% |
89.67% |
74.69% |
| 12.0 |
…… |
93.32% |
82.62% |
…… |
| 20.0 |
94.75% |
…… |
…… |
…… |
| 20.0 |
92.99% |
…… |
…… |
…… |
【解释与结论】
(1)次氯酸钠(NaClO)中Cl元素的化合价为 。
(2)综合分析探究一中数据,在其他条件不变时,0.5%的84消毒液有效氯存留率受温度和时间的影响,其影响的变化趋势是 ,因此保存84消毒液应注意的问题是 。
探究二:不同浓度84消毒液的杀菌效果
在四只试管中各加入鸡蛋液2mL,分别加入不同浓度的消毒液,静置15分钟后,记录如下:
| 序号 |
2﹣1 |
2﹣2 |
2﹣3 |
2﹣4 |
| 实验操作 |
加入0.5mL消毒原液 |
加入0.5mL清毒 原液,12.5mL水 |
加入0.5mL消毒原液,50mL水 |
加入0.5mL消毒原液,100mL水 |
| 现象 |
液体表面产生气泡,无其他现象 |
液体中产生大量白色固体 |
液体中产生少量白色固体 |
液体中产生极少量白色固体 |
【解释与结论】
(3)探究二中杀菌效果最好的一组实验为 (填序号)。
(4)洁厕灵主要成分是盐酸,与84消毒液混合会产生有毒气体Cl 2,完成反应的化学方程式:2HCl+NaClO═Cl 2↑+H 2O+ 。