粗盐中常含有MgCl2、CaCl2、Na2SO4及泥沙等杂质,常用下面的流程进行提纯。下列说法正确的是( )
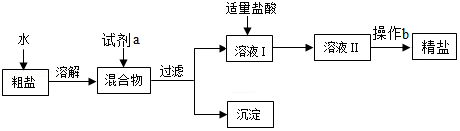
A.加入试剂a的顺序可以是过量的NaOH溶液、Na2CO3溶液,BaCl2溶液
B.加入试剂a后,将混合物过滤,得到的沉淀中除泥沙外还含有3种不溶物
C.向溶液Ⅰ中加入的盐酸也可以是过量的
D.操作b的名称为过滤
粗盐中含有泥沙等不溶性杂质,还含有氯化钙、氯化镁、硫酸钠等可溶性杂质。
提纯粗盐并制取纯碱的工艺流程如图:
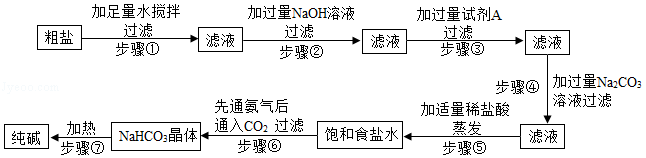
已知:①20℃时,将CO2通入含有NH3的饱和NaCl溶液中生成NaHCO3晶体和NH4Cl溶液
②20℃时,几种物质在水中的溶解度/g
NaCl |
NH4Cl |
NaHCO3 |
36.0 |
37.2 |
9.6 |
请根据上述题中有关信息,回答下列问题:
(1)步骤③中加入试剂A的化学式是 ;
(2)步骤④中加入过量Na2CO3溶液的目的是 ;
(3)在步骤⑥反应中,有NaHCO3晶体析出,而没有NH4Cl和NaCl析出的原因是 ;
(4)步骤⑦中NaHCO3转化为纯碱的化学反应方程式是2NaHCO3 Na2CO3+CO2↑+H2O,该化学反应属于 反应(填基本反应类型)。
请回答下列实验问题:
(1)现提供下列装置:

①如图E装置中,甲仪器的名称是 。
②实验室用KClO3和MnO2混合制O2,发生装置可选用 (填装置序号),用装置C干燥O2,气体由导管 端(填“a”或“b”)进入,用E装置收集O2的依据是 。
③英国化学家布莱克是第一个“捕捉”到CO2的人,实验室制备CO2的化学方程式为 ;1774年德国化学家贝格曼将CO2通入紫色石蕊试液中,发现试液由紫色变为红色,此反应的化学方程式为 。
(2)对一定质量的粗盐(含泥沙)进行初步提纯。
①实验的主要步骤:称量与溶解、过滤、蒸发;蒸发结束后用 (填仪器名称)将固体从蒸发皿转移到纸片上,比较食盐提纯前后的状态。
②下列有关蒸发过程说法正确的是 (填序号)。
a.蒸发时用玻璃棒不断搅拌
b.当蒸发皿中水分全部蒸干时,停止加热
c.蒸发时若有滤液溅出,则精盐质量将偏低
d.蒸发过程中,溶液中钠元素质量增大
如图为“去除粗盐中难溶性杂质并计算产率”的实验操作示意图:

(1)请将上述操作进行合理排序: (填序号)、计算;请改正操作④中的错误 ;
(2)操作②中,用玻璃棒不断搅拌的目的是 ;
(3)过滤后,如果滤液仍然浑浊,其原因可能是 ;
(4)通过以上操作只能除去粗盐中难溶性杂质,欲除去可溶性杂质如MgCl2、CaCl2,得到纯净的NaCl,还需依次用到NaOH溶液、Na2CO3溶液和稀盐酸(三种药品均过量);
①碳酸钠溶液要过量的原因是 ;②稀盐酸的作用是 。
请回答下列问题。
(1)下列实验操作的说法正确的是 (多选,请在答题卡选择题区域填涂作答)。
A.加热蒸发皿时,要垫上石棉网
B.电解水实验中,加入少量Na2SO4以增强水的导电性
C.氢气还原CuO实验中,先通入氢气,后加热
D.用pH试纸放入待测溶液中,测得pH=2
E.将NaOH固体直接置于托盘天平右盘上称量
(2)粗盐中含有少量CaCl2、MgSO4、Na2SO4,和泥沙等杂质。请完成提纯操作:①将固体粗盐样品 ②依次加入稍过量的 A NaOH溶液、B.Na2CO3溶液C BaCl2溶液,加入试剂的先后顺序用字母表示为 → → ;③过滤除去沉淀,再加稍过量的稀盐酸;④蒸发结晶。从NaCl的溶解度与温度的关系看,在结晶过程中,不采用冷却热的饱和溶液的方法获得晶体,理由是 。
化学是一门以实验为基础的科学,通过实验可以发现和验证化学原理,获得新的化学知识。请回答下列与化学实验有关的问题:
(1)利用课本实验测定空气里氧气的含量。得到氧气的含量小于 ,可能的原因是: 。(写一种即可)
(2)证明铜和铁金属活动性强弱的实验方法是: 。(写一种即可)
(3)在粗盐提纯实验的步骤中多处用到了玻璃棒,写出其中玻璃棒的作用 。(写一种即可)
下列知识整理的内容中,有错误的一组是( )
| A.除杂的方法 |
B.化学物质中的"三" |
| 粗盐提纯﹣﹣溶解、过滤、蒸发 木炭粉中混有铁粉﹣﹣用磁铁吸引 除去空气中的氧气﹣﹣通过灼热的铜粉 |
三大化石燃料﹣﹣煤、天然气、石油 三种黑色氧化物﹣﹣氧化铜、二氧化锰、四氧化三铁 三大合成材料﹣﹣塑料、合成纤维和合成橡胶 |
| C.实验安全注意事项 |
D.日常物质的区别 |
| 制取气体﹣﹣先检查装置的气密性 厨房天然气泄漏﹣﹣要立即打开换气扇 酒精灯熄灭﹣﹣用灯帽盖灭 |
硬水和软水﹣﹣加肥皂水并搅拌 酱油和食醋﹣﹣闻气味 羊毛纤维与合成纤维﹣﹣灼烧、闻气味 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
“久大盐化”是四川遂宁的重点企业,其生产的食盐是重要的调味品。绿色应用是化工生产的发展方向。为了除去NaCl溶液中含有的少量MgCl2、CaCl2和Na2SO4,某小组同学选用Na2CO3溶液、稀盐酸、Ba(OH)2溶液三种试剂,按一定顺序进行如图所示的实验。回答下列问题:

(1)操作a的名称是 。
(2)实验Ⅰ中加入的试剂B是 。(填序号)
①稀盐酸
②碳酸钠溶液
③氢氧化钡溶液
(3)实验Ⅱ中发生中和反应的化学方程式是 。
海水晒盐得到粗盐,剩余的母液称为苦卤,粗盐和苦卤用途广泛.
(1)为了除去粗盐溶液中的Ca 2+、Mg 2+、SO 4 2﹣,可按照下列实验步骤进行:①加过量BaCl 2溶液②加过量NaOH溶液③加过量Na 2CO 3溶液④过滤⑤加入适量盐酸.其中步骤③加过量Na 2CO 3溶液的目的是 .
(2)利用苦卤制取镁,主要流程如图:

步骤Ⅱ中的试剂a是 .步骤Ⅰ中反应的化学方程式是 .
(3)采用氨碱法生产纯碱,主要流程如图:

①上述Ⅰ、Ⅱ两个步骤总反应的化学方程式是 .
②从步骤Ⅱ过滤后的滤液中可获得铵态氮肥.检验铵态氮肥的方法是 .
酸碱盐在工农业生产和生活中应用广泛,请用所学化学知识回答问题。
(1)日常生活中有以下常见物质:白醋、纯碱、苛性钠、小苏打、硫酸铵,其中属于碱的是 (填上述物质)。将少量无色酚酞溶液滴加到碱溶液中,溶液变 。
(2)如饮食不当,胃会分泌出大量胃酸,服用含有下列哪种物质的药物可以中和过多胃酸,写出反应的化学方程式 。
A.NaOH B.Na2CO3 C.Al(OH)3
(3)某氯化钠样品中,可能含有杂质:BaCl2、MgCl2、Na2SO4中的一种或几种,某校课外化学兴趣小组的同学进行实验探究杂质成分,探究过程如图(已知氢氧化镁难溶于水):

根据以上实验信息,用 操作方法,可将上述实验过程中产生的白色沉淀与溶液分离,加入适量NaOH溶液的目的是 ,写出杂质与Na2SO4溶液反应的化学方程式 。
通过海水晒盐可得到粗盐。化学兴趣小组为了除去粗盐中难溶性杂质,进行了如图操作:

(1)上述操作的正确顺序是 (填序号)。
(2)下列情况可能导致精盐产率偏低的是 (填字母代号)。
A.溶解时加入的水过少导致粗盐未溶完
B.过滤时漏斗内液面超过滤纸边缘
C.蒸发时有液体飞溅
D.所得精盐中含有少量水分
海洋是一个巨大的资源宝库。海水资源综合利用的部分途径如图。
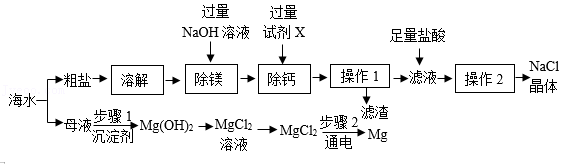
已知:粗盐中的杂质有泥沙、MgCl2、CaCl2,流程中部分操作及试剂已省略。
(1)试剂X的作用是除去粗盐中的Ca2+,则试剂X为 (填化学式)。
(2)“操作1”中玻璃棒的作用是 ,“操作2”的名称为 。
(3)滤渣中除泥沙外,还含有 。
(4)实际生产中,步骤1常选用 作为沉淀剂。
(5)步骤2需电解 状态的MgCl2以获得金属镁。
为除去粗盐中混有的泥沙,某学习小组按以下步骤进行实验:(实验环境温度为20℃)
Ⅰ.称量与溶解Ⅱ.过滤Ⅲ. 。
请回答下列问题:
(1)将步骤Ⅲ补充完整。
(2)如图中图1为氯化钠的溶解度曲线,图2为步骤Ⅰ中的部分操作:

①由图1给出的信息可知:20℃时,NaCl的溶解度是 g。
②从节约能源和提高产率的角度分析,图2中所需水的最佳体积是 mL.(提示:水的密度为1g•mL﹣1;产率 100%)
③用玻璃棒搅拌的目的是 。
(3)过滤时,若漏斗中的液面高于滤纸的边缘,造成的后果是 (填字母)。
a.过滤速度慢
b.滤纸破损
c.部分杂质未经过滤进入滤液
某同学为除去食盐水中的Na2SO4杂质,进行了以下实验:
下列有关说法错误的是( )
A.X为BaCl2溶液B.Y为Na2CO3
C.Z为稀盐酸D.步骤②与④可交换