钙是生物体骨骼的重要组成元素。鱼骨中含有碳酸钙,现设计图甲实验测定鱼骨中的碳酸钙含量,并将测得的数据绘制成图乙。

提示①食醋的主要成分是醋酸(HAc)。醋酸和碳酸钙反应的化学方程式为CaCO3+2HAc═CaAc2+H2O+CO2
②鱼骨中其它成分与食醋反应生成的气体可忽略不计
(1)该实验中浓硫酸的作用是 。
(2)由图乙中的AB曲线,可知锥形瓶中反应速率的变化情况是 (选填“变大”、“变小”或“不变)。
(3)根据图中的数据计算鱼骨中碳酸钙的质量分数。
(4)生活中,用喝醋的方法除去卡在咽上的鱼刺,这种做法是不科学的。请你结合实验结果加以说明 。
某同学用溶质质量分数为15%的稀盐酸和大理石反应来制取二氧化碳气体:
(1)用20.3g溶质质量分数为37%的浓盐酸能配制上述稀盐酸 g(结果精确到1g)。
(2)若需收集10瓶(每瓶以125mL计算)二氧化碳气体,同至少需要多少克上述稀盐酸与足量的大理石反应才能制得(实验条件下二氧化碳的密度为2g/L)?(写出计算过程,结果精确到0.01g)
人体所需的维生素C(化学式为C 6H 8O 6)主要从蔬菜、水果中摄取,计算:
(1)维生素C中碳、氢、氧三种元素质量的最简整数比为 。
(2)现有溶质质量分数为1%的维生素C的溶液300g,若配制成溶质质量分数为0.3%的维生素C的溶液,问需要加水的质量是多少。(写出计算过程)
向100克MgCl 2和HCl的混合溶液中,逐滴加入10%的氢氧化钠溶液,反应情况,如图所示。
(1)当滴加氢氧化钠溶液的质量至N点时所得溶液的pH值为 (填编号);
A.大于7 B.等于7 C.小于7
(2)通过计算,确定M点的值,写出计算过程。
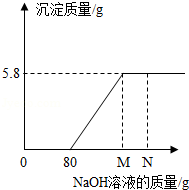
工业盐酸中通常溶有少量的FeCl 3而呈黄色,小红为测定某工业盐酸中HCl的含量进行如下实验:取某工业盐酸l00g,滴加一定溶质质量分数的NaOH溶液,测得加入NaOH溶液质量与反应生成的沉淀质量关系如图所示,FeCl 3与NaOH反应的化学方程式为FeCl 3+3NaOH═Fe(OH) 3↓+3NaCl.请回答下列问题:
(1)FeCl 3与NaOH恰好完全反应时,生成沉淀的质量是 g。
(2)该工业盐酸中HCl的质量分数是多少?(写出计算过程)
(3)取l00g该工业盐酸稀释成HCl质量分数为10%的稀盐酸,需加多少克水?(写出计算过程)

大理石是含杂质的碳酸钙,因具有美丽花纹而被广泛用于建筑物外墙、内壁的贴面和地面铺设。某同学想测出大理石样品中碳酸钙的含量,进行了如下实验和分析。

(1)取一定量的大理石样品置于图甲的发生装置中,用分液漏斗向下滴加盐酸(CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑,杂质不参加反应),产生的气体用含有碱性物质的吸收装置充分吸收。分液漏斗中所加液体不选用硫酸,理由是 。
(2)反应前,测得图甲中锥形瓶内物质的总质量和吸收装置的总质量都为m克。实验后,根据实验数据绘制了图乙,曲线a、b分别表示锥形瓶内物质的总质量和吸收装置的总质量随反应时间变化的情况。请根据曲线b分析计算出大理石样品中碳酸钙的质量。
(3)请综合分析曲线a、b,计算出实验中所用盐酸的溶质质量分数。(结果精确到0.1%)
(4)计算后,该同学对上述实验进行了反思。他认为分液漏斗中选用的盐酸浓度偏大会对实验结果造成较大影响,其原因是 。
每年5、6月是蓝莓丰收的时节,蓝莓中含有丰富的花青素(化学式为C 15H 11O 6)。花青素是一种水溶性色素,颜色与细胞液的酸碱性有关,细胞液酸性时呈红色,碱性时呈蓝色。
(1)在白醋中滴加花青素,溶液变 色。
(2)一个花青素分子中共有 个原子。
(3)28.7克花青素中含有多少克碳元素(请列式计算)

在锥形瓶中加入80.0g质量分数为10%的硫酸铜溶液,塞好橡胶塞。将几根铁钉用砂纸打磨干净后在天平上称得质量为56.0g,再将盛有硫酸铜溶液的锥形瓶和铁钉一起放在天平上称量,记录所称得质量m 1.将上述铁钉浸到硫酸铜溶液中,待反应一段时间后溶液颜色改变时,将盛有硫酸铜溶液和锥形瓶放在天平上称量,记录所称的质量为m 2。
(1)m 1 m 2(填">"或"="或"<")。
(2)锥形瓶的质量为 (用含m 1或m 2的代数式表示)。
(3)若硫酸铜反应完全,求此时所得溶液的质量(写出计算结果)。
现有一含NaCl杂质的Na2CO3样品,取13.9g样品溶于水,配成104.4g溶液,此溶液与100g某浓度的盐酸恰好完全反应,得到200g溶液。请计算:
(1)生成的二氧化碳的质量为 g;
(2)所得溶液中NaCl的质量分数(写出计算步骤)。
有一部分变质的KOH样品,含有杂质K2CO3和H2O.取一定量该样品,溶于100克质量分数为18.25%的盐酸中充分反应后,再加入一定质量质量分数为10%的KOH溶液反应至中性。问:
(1)当样品与100克质量分数为18.25%的盐酸充分反应后,此时溶液pH 7(填“>”、“<”、或“﹦”)。
(2)把反应后的溶液蒸干后可得到的固体是 (填名称)。
(3)把反应后的溶液蒸干后可得到固体的质量是多少克?(写出简要的计算过程,计算结果精确到0.01)
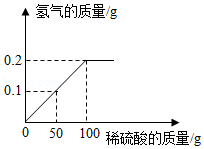
铜锌合金又称假黄金。向盛有30g铜锌合金粉末样品的烧杯中逐渐加入稀硫酸,生成氢气的质量与加入稀硫酸的质量关系如图所示,计算:
(1)充分反应后生成氢气的质量为 g。
(2)合金样品中锌的质量。
(3)恰好完全反应时,所得溶液溶质的质量分数。(结果保留一位小数)
某碳酸钾样品中混有少量氯化钾杂质,取一定量样品于烧杯中,向烧杯中加入100g质量分数为7.3%的稀盐酸,此时恰好完全反应,将所得溶液蒸干得到18.1g固体,计算样品中碳酸钾的质量分数?(计算结果精确到0.1%)
取10g氢氧化钠溶液于烧杯中,向其中加入10g溶质质量分数为9.8%的稀硫酸恰好完全反应。请计算:
反应后所得溶液的溶质质量分数。(计算结果精确到0.1%)
为测定硫酸钠和硫酸镁固体混合物中硫酸镁的质量分数。某同学取固体混合物26.2g,向其中加入219.6g水,使其完全溶解配制成混合溶液。将200g一定溶质质量分数的氢氧化钠溶液平均分成5等份,依次加入到上述混合溶液中,生成沉淀的质量与加入氢氧化钠溶液的质量关系如下表:
| 次数 |
第一次 |
第二次 |
第三次 |
第四次 |
第五次 |
| 氢氧化钠溶液质量/g |
40 |
40 |
40 |
40 |
40 |
| 产生沉淀质量/g |
1.45 |
2.9 |
m |
5.8 |
5.8 |
试分析计算。
(1)m的值为 。
(2)固体混合物中硫酸镁的质量分数。(结果保留0.1%)
(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数。