氢气在氯气中燃烧的化学方程式是H2+Cl2 2HCl,该反应属于( )
2HCl,该反应属于( )
| A.分解反应 | B.化合反应 | C.复分解反应 | D.置换反应 |
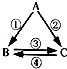
已知A、B、C是初中化学的常见物质,其相互关系如图所示.若A、B是组成元素相同且常温下都为液态的氧化物,C为供给呼吸,则A的化学式为 ,C为化学式为 ,反应①的化学方程式为 .
下列对催化剂的描述不正确的是( )
| A.有些化学反应可以有多种催化剂 |
| B.任何化学反应都需要催化剂 |
| C.催化剂在反应前后的质量和化学性质都不变 |
| D.加入催化剂后生成物的总量不会增加 |
实验是化学的基础,下列说法正确的是( )
| A.若洒出的酒精在桌上燃烧起来,应立即用水浇灭 |
| B.检验二氧化碳气体,可用燃着的小木条 |
| C.硫在空气中燃烧,发出明亮的蓝紫色火焰,放热,产生有刺激性气味的气体 |
| D.某物质在氧气中燃烧产物只有二氧化碳和水,则该物质中一定有碳、氢元素 |
已知A、B、C、D、E五种物质之间存在以下转化关系.其中A、C两种物质的组成元素相同,且常温下是液体,E是天然气的主要成分(甲烷).

请回答:
(1)写出DE两种物质的化学式:D ,E .
(2)写出A→B+C的化学方程式: .
(3)写出D物质的一种用途: .
Sb2O5是一种重要的阻燃剂.用X来生成该阻燃剂的化学方程式为:X+2H2O2═Sb2O5+2H2O.根据质量守恒定律,推断X的化学式为( )
| A.SbO2 | B.Sb2O3 | C.HSbO3 | D.H3SbO4 |
在用白磷探究质量守恒定律的实验中,同学将橡皮塞上的细玻璃管下端放到酒精灯火焰上灼烧至红热后,迅速用橡皮塞将锥形瓶塞紧,并引燃白磷,实验过程如下图所示.请回答下列问题: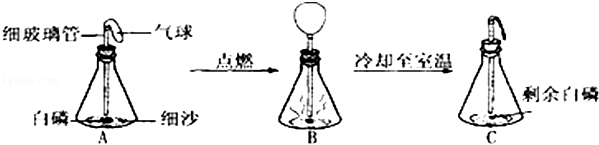
(1)图中瓶底铺细沙的作用是: .
(2)白磷刚引燃,立即将锥形瓶放到天平上称量,天平不平衡.结论是质量不守恒.待锥形瓶冷却后,重新放到托盘天平上称量,天平保持平衡.结论是:质量守恒.你认为结论正确的是 ( 填“前一种”或“后一种”).而导致另一种结论错误的原因是 ..
(3)实验观察到A、C中气球的大小不同,用理化知识解释产生此现象的原因是:
(4)由质量守恒定律可知,化学反应前后,一定不变的是 .(填序号)
①原子种类 ②原子数目 ③分子种类 ④分子数目 ⑤元素种类 ⑥物质种类.
在A+3B=2C+2D的反应中,14克A完全反应生成44克C和18克D,若A的相对分子质量为28,则B的相对分子质量是
| A.16 | B.32 | C.64 | D.96 |
在生活中重金属盐类也可作为消毒杀菌的药物来使用,如图所示为硝酸银滴眼液药品说明书的一部分.从其贮藏条件“遮光”可以看出,硝酸银溶液具有 的化学性质.“滴眼后用0.9%的生理盐水冲洗”来减轻硝酸银对眼睛的腐蚀性,应用的科学原理是: (用化学方程式表示).

某同学选择“金属和酸反应的快慢与什么因素有关”的课题开展探究.下表是他们分别用接触面积、质量相同的金属丝和足量稀酸反应的三组实验数据:
| 实验编号 |
反应物 |
酸的质量分数% |
反应的温度℃ |
金属丝消失的时间s |
| ① |
铝丝和稀盐酸 |
5 |
20 |
450 |
| ② |
铝丝和稀盐酸 |
10 |
20 |
240 |
| ③ |
铝丝和稀盐酸 |
10 |
30 |
65 |
| ④ |
铁丝和稀盐酸 |
10 |
30 |
125 |
| ⑤ |
铝丝和稀硫酸 |
10 |
30 |
超过1000 |
(1)实验开始前都需要用砂纸充分打磨金属,目的是:
(2)对比试验 可知,金属和酸反应的快慢还与金属的种类有关.
(3)本通过测量 来反应金属和酸反应的快慢.
(4)通过比较实验①和②可得出实验结论: .
下列反应能够发生的是
| A.Zn+MgSO4═ZnSO4+Mg |
| B.Cu+2AgCl═CuCl2+2Ag |
| C.2KCl+Na2SO4═K2SO4+2NaCl |
| D.NaCl+AgNO3═AgCl↓+NaNO3 |
工业上可用氧化钛和金属镁反应制取钛金属,化学方程式如下:TiCl4+2Mg Ti+2MgCl2,该化学方程式属于基本反应类型中的
Ti+2MgCl2,该化学方程式属于基本反应类型中的
| A.化合反应 | B.分解反应 | C.复分解反应 | D.置换反应 |
2004年4月18 日全国铁路进行了第五次大提速.为适应提速,需将原有的短轨连接为超长轨.常用2Al+Fe2O3 Al2O3+2Fe这一反应原理来焊接钢轨.有关该反应的下列说法中,正确的是
Al2O3+2Fe这一反应原理来焊接钢轨.有关该反应的下列说法中,正确的是
| A.该反应属于化合反应 | B.该反应属于复分解反应 |
| C.该反应属于分解反应 | D.该反应属于置换反应 |
下列四个短语,其原意一定包含化学变化的是
| A.花香四溢 | B.海市唇楼 | C.木已成舟 | D.烟花绽放 |