金属资源在生产生活中应用十分广泛。请回答下列问题。
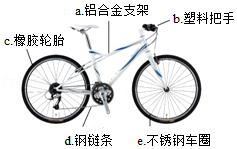
(1)“共享单车”方便市民出行,颇受人们的喜爱。
①如图所示,单车上标示出的部件中由金属材料制成的是 (填字母序号)。
②为防止钢链条生锈可采取的措施是 。
③废旧单车中金属部件回收再利用的意义是 (写一点即可)。
(2)将一定量的铜粉放入盛有硝酸锌和硝酸银混合溶液的烧杯中,请写出烧杯中发生反应的化学方程式: 。将烧杯中的物质过滤,所得滤液中溶质的组成有 种情况。
将X、Z两种金属分别放入Y(NO 3) 2的溶液中,仅X的表面有Y单质析出,则X、Y、Z三种金属的活动性顺序是( )
| A. |
Z>X>Y |
B. |
X>Y>Z |
C. |
X>Z>Y |
D. |
Y>X>Z |
金属的发现与使用历史体现了人们对其性质的认识和科技发展的水平。
(1)2021年3月,三星堆遗址再次出土的文物中,黄金面具残片最为引人瞩目,其历经三千年依旧金光灿灿,这是因为金的化学性质非常 。
(2)唐宋时期流行的“湿法炼铜”的原理是铁和硫酸铜溶液的反应,该反应的化学方程式为 。
(3)《周礼•考工记》中有关于将铜、锡以不同比例熔合制成功能各异的青铜器的记载。将铜片和锡片分别伸入稀盐酸中,锡片表面有气泡生成而铜片没有,说明金属活动性锡
(填“>”或“<”)铜。
经过实验探究,人们总结出了金属活动性顺序规律,下列有关说法正确的是( )
| A. |
金属铝比铁更耐腐蚀,是因为铁更活泼 |
| B. |
工业上可以利用单质铁回收硫酸锌溶液中的金属锌 |
| C. |
铜、银单质分别与稀盐酸混合,铜置换出氢气更快 |
| D. |
金属活动性顺序可作为金属能否在溶液中发生置换反应的一种判断依据 |
在两只烧杯中分别放入相同质量的镁、锌两种金属,然后向两只烧杯中分别倒入相同质量、相同质量分数的稀硫酸,反应产生氢气的质量与消耗硫酸的质量关系见图。综合以上信息得到以下结论,合理的是( )

A.从图象可以看出,金属镁比金属锌的活动性强
B.若两种金属都有剩余,二者得到的氢气质量相同
C.若硫酸有剩余,二者得到氢气的质量相同
D.若两种金属完全溶解,二者消耗硫酸的质量相同
金属材料与人类生活息息相关,请回答下列问题。
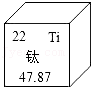
(1)钛元素在元素周期表中的信息如图所示,则钛的相对原子质量是 。
(2)家用台灯通常采用铜质插头,是利用金属铜的 性。
(3)我国是最早采用湿法炼铜的国家,铁与硫酸铜溶液反应的化学方程式是 。
(4)将一定质量的Zn片加入AgNO3、Cu(NO3)2的混合溶液中,充分反应后过滤,得到滤渣和滤液,则滤渣中一定含有的金属是 ;若滤液蓝色,则滤液中溶质一定有 。
金属在生活、生产中有着广泛的应用,种类繁多的金属材料已成为社会发展的重要物质基础。
(1)实验室所用的石棉网中有铁丝,隔着石棉网给容器加热可达到均匀受热的目的,这主要利用了铁的 性。石棉网使用一段时间后,其中的铁丝容易生锈,可用稀盐酸除去,其化学方程式可表示为 。
(2)某化学兴趣小组将一定质量的Fe和Zn的混合粉末加入AgNO3溶液中,充分反应后过滤,得到滤渣和滤液:
①如果滤液呈无色,则滤渣中一定含有的金属是 ;
②如果滤液中加入稀盐酸有白色沉淀,则滤液中的金属阳离子有 种;
③如果滤液呈浅绿色,则关于该滤渣和滤液的下列说法中正确的是 。
A.向滤渣中加入稀盐酸,一定有气泡产生
B.向滤液中加入稀盐酸,一定有白色沉淀产生
C.滤渣中一定含有Ag
D.滤液中一定含有Fe(NO3)2,一定不含AgNO3,可能含有Zn(NO3)2
将一定量的铝粉投入到含溶质为Mg(NO 3) 2、Cu(NO 3) 2、AgNO 3的溶液中,充分反应后过滤,滤液无色;向滤渣中滴加稀盐酸,无明显现象。下列说法错误的是( )
| A. |
滤渣中一定有Ag、Cu |
| B. |
滤渣中一定有Ag,可能有Cu,没有Mg |
| C. |
滤液中一定没有Cu(NO 3) 2、AgNO 3 |
| D. |
滤液中一定有Al(NO 3) 3、Mg(NO 3) 2 |
有X、Y、Z三种金属,为判断其活动性顺序,某兴趣小组的同学做了如下实验:①将X、Y、Z分别置于稀盐酸中,X有气体产生,Y、Z无明显现象;②将Y金属放入Z的盐溶液中,无现象。则X、Y、Z的活动性顺序为( )
| A. |
Y>Z>X |
B. |
X>Y>Z |
C. |
Y>X>Z |
D. |
X>Z>Y |
将一定量金属M加入到ZnSO 4和CuSO 4的混合溶液中,充分反应后,过滤,得到固体滤渣,滤液为无色,向滤渣中滴加稀盐酸有气泡产生。下列有关判断正确的是( )
| A. |
金属活动性:M>Zn>Cu |
| B. |
滤液中可能只含一种溶质 |
| C. |
滤渣中一定含有金属M |
| D. |
该过程一定发生了如下反应:M+CuSO 4═Cu+MSO 4 |
人类文明进步与金属材料发展关系十分密切。回答下列问题。
(1)元素在自然界分布并不均匀,按质量计算,地壳中含量最多的金属元素是 (填符号)。
(2)钢铁是应用最普遍的金属材料,某些铁制零件防锈措施是涂油,其防锈原理为 。
(3)《吕氏春秋》记载“金柔锡柔,合两柔则刚(即坚硬)”【注:金指铜单质,锡指锡单质】。这句话说明铜锡合金具有的特性是 (填字母)。
a.合金的熔点一般比其组分低
b.合金的硬度一般比其组分大
c.合金的抗腐蚀性一般比其组分强
(4)向硝酸银和硝酸锌的混合溶液中加入一定量的铜粉,观察到溶液由无色变为蓝色后,对混合溶液进行过滤,则滤液中一定含有的溶质是 。
向AgNO 3、Cu(NO 3) 2、Mg(NO 3) 2的混合溶液中加入一些锌粉,完全反应后过滤。不可能存在的情况是( )
| A. |
滤纸上有Ag,滤液中有Ag +、Cu 2+、Zn 2+、Mg 2+ |
| B. |
滤纸上有Ag、Cu,滤液中有Zn 2+、Mg 2+ |
| C. |
滤纸上有 Ag、Cu、Zn、Mg,滤液中有Zn 2+ |
| D. |
滤纸上有Ag、Cu、Zn,滤液中有Zn 2+、Mg 2+ |
向硝酸银和硝酸铜的混合溶液中加入一定量的锌粉,充分反应后过滤,得到滤渣和滤液,滤液呈蓝色。下列说法正确的是( )
A.滤渣中—定有Ag、Cu
B.滤液中一定有Cu2+、Zn2+
C.向滤渣中滴加稀盐酸一定有气泡产生
D.向滤液中加入稀盐酸一定有沉淀生成
金属在生产、生活和社会发展中应用较为广泛,中国制造,让世界瞩目!
(1)航天:我国用长征三号乙运载火箭成功发射第55颗北斗导航卫星,化学材料在其中起到了重要作用,铝合金和钛合金被广泛用于航天工业、一般情况下,铝合金的强度和硬度比纯铝 (填“高”或“低”)。
(2)交通:制造港珠澳大桥需要大量的钢铁,请写出一种防止钢铁生锈的方法: 。
(3)冶炼:我国湿法炼铜很早就有记载,东汉《神农本草经》曾记载石胆“能化铁为铜”。向硝酸铜和硝酸银的混合溶液中加入一定量的镁粉,充分反应后过滤,滤液呈蓝色,则滤出的滤液中一定含有金属离子是 。
(4)应用:随州编钟被誉为“世界第八大奇迹”,代表了我国古代青铜工艺的较高水平,青铜是铜锌合金。现有铜锌合金质量20克,与100克质量分数为19.6%的稀硫酸恰好完全反应,则铜锌合金中铜的质量分数为 。