根据如图信息进行计算(已知石灰石中的杂质既不入于水,也不与酸反应)

(1)15g石灰石中碳酸钙的质量为 g。
(2)所得溶液中溶质的质量分数。
向200g NaCl和BaCl2的混合溶液中加入Na2CO3溶液。反应过程中滴加Na2CO3溶液的质量与生成沉淀的质量关系如图所示。请计算:
(1)m的值是 g;
(2)原混合溶液中BaCl2的质量分数是多少?

取6.8g含杂质的锌粒于烧杯中,向其中加入稀硫酸至恰好完全反应,共用去稀硫酸100g,实验结束后,称得烧杯中物质的总质量为106.6g。(杂质不溶于水也不与稀硫酸反应)请计算:
(1)产生氢气的质量为 g
(2)所用稀硫酸中溶质的质量分数。(写出计算过程)
为测定硫酸钠和硫酸镁固体混合物中硫酸镁的质量分数。某同学取固体混合物26.2g,向其中加入219.6g水,使其完全溶解配制成混合溶液。将200g一定溶质质量分数的氢氧化钠溶液平均分成5等份,依次加入到上述混合溶液中,生成沉淀的质量与加入氢氧化钠溶液的质量关系如下表:
|
次数 |
第一次 |
第二次 |
第三次 |
第四次 |
第五次 |
|
氢氧化钠溶液质量/g |
40 |
40 |
40 |
40 |
40 |
|
产生沉淀质量/g |
1.45 |
2.9 |
m |
5.8 |
5.8 |
试分析计算。
(1)m的值为 。
(2)固体混合物中硫酸镁的质量分数。(结果保留0.1%)
(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数。
工业盐酸中通常含少量FeCl3而呈黄色。小亮为测定某工业盐酸中HCl的含量进行如下实验,取某工业盐酸50g,滴加溶质质量分数为20%的NaOH溶液,反应过程中,当加入的NaOH溶液质量至以下数值时,对充分反应后所得溶液的质量进行了测定,部分数据如下表,请根据表格和图象完成下列问题:
|
加入NaOH溶液的质量/g |
25 |
50 |
75 |
100 |
|
所得溶液的质量/g |
75 |
100 |
125 |
m |
(1)开始没有产生沉淀的原因是 。
(2)求该工业盐酸中HCl的质量分数(写出计算过程)。
(3)m= (结果保留两位小数)。

实验室用含杂质的锌(也称粗锌)与盐酸反应制取氢气,取8.0g含杂质的锌粒于烧杯中(所含杂质不溶于水,也不与酸反应),向其中加入73.0g稀盐酸,恰好完全反应后烧杯内剩余物质的质量为80.8g。计算:
(1)生成氢气的质量 g。
(2)求稀盐酸的溶质质量分数(请写出计算过程)。
将含有可溶性杂质的某氯化钠样品1.5g溶于足量水中得到不饱和溶液,再向所得溶液中小心滴入100g一定溶质质量分数的AgNO 3溶液(杂质不与AgNO 3溶液反应).实验过程中,生成沉淀的质量与滴入AgNO 3溶液的质量关系如图所示,试计算:
(1)恰好完全反应时生成沉淀的质量是 .
(2)样品中氯化钠的质量是多少?
(3)原硝酸银溶液中溶质质量分数是多少?

有一不纯的氯化钠固体样品(杂质不溶于水),取样品25克放入烧杯中,然后加入80克水使其充分溶解,静置后过滤取58.5克滤液,加入126.2克硝酸银溶液恰好完全反应生成白色沉淀,过滤后得到156克溶液。
计算:(1)生成白色沉淀的质量。
(2)58.5克滤液中溶质的质量分数。
(3)样品中氯化钠的质量分数。
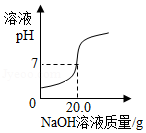
梧州市某化学兴趣小组检测某硫酸厂排放的废液中硫酸的含量,取废液样品100g,逐滴加入4%的NaOH溶液,溶液的pH随加入NaOH溶液质量变化如图所示(假设废液中其它成分均为中性,且不和NaOH反应)。
请计算:
(1)H 2O的相对分子质量= 。
(2)该废液中硫酸的质量分数。(结果精确到0.01%)
某同学称量5g木炭粉与氧化铜高温加热一段时间后的剩余固体于烧杯中,向烧杯中加入稀硫酸,发现烧杯中剩余固体的质量与加入稀硫酸质量的关系如图所示。回答下列问题:
(1)木炭粉与氧化铜反应一段时间后剩余固体中除Cu外,一定含有的物质是 ,该物质在剩余固体中的质量分数是 。
(2)求所加稀硫酸的溶质质量分数。

取2g氧化铜固体于烧杯中,向其中加入一定量的稀硫酸,恰好完全反应,得到的溶液质量为51g。请计算:该稀硫酸中溶质的质量分数。
小宁用稀盐酸和石灰石反应制取二氧化碳(石灰石中的杂质既不溶于水也不和酸反应),为了探究反应后溶液的成分,他又进行如下实验:取反应后的溶液50g于烧杯中,逐滴滴入碳酸钠溶液,发现先有气泡产生,后生成白色沉淀。下表为产生的气体总质量、沉淀总质量与滴入碳酸钠溶液总质量的关系。
|
碳酸钠溶液总质量/g |
25.0 |
50.0 |
75.0 |
100.0 |
125.0 |
150.0 |
175.0 |
200.0 |
|
气体总质量/g |
1.1 |
2.2 |
2.2 |
2.2 |
2.2 |
2.2 |
2.2 |
2.2 |
|
沉淀总质量/g |
0 |
0 |
2.5 |
5.0 |
m |
n |
9.0 |
9.0 |
(1)表中n= 。
(2)所取的反应后50g溶液中溶质是 。
(3)所用碳酸钠溶液中溶质的质量分数是多少?
为测定某盐酸的溶质质量分数,取200g样品于烧杯中,将50g碳酸钠溶液分为5等份,分5次加入盛有样品的烧杯中。测出每次反应后溶液的总质量,实验数据如下表:
|
第一次 |
第二次 |
第三次 |
第四次 |
第五次 |
|
|
加入Na2CO3溶液的质量 |
10g |
10g |
10g |
10g |
10g |
|
反应后溶液的质量 |
208.9g |
217.8g |
226.7g |
235.6g |
245.6g |
请根据实验数据计算盐酸的溶质质量分数。
为测定某石灰石样品中碳酸钙的质量分数,取25g该样品(杂质不参加反应也不溶于水),加入盛有146g稀盐酸的烧杯中,恰好完全反应,气体全部逸出,反应后烧杯内物质的总质量为162.2g。计算:
(1)生成二氧化碳的质量;
(2)石灰石样品中碳酸钙的质量分数;
(3)反应后所得溶液中溶质的质量分数(结果精确至0.1%)。