硝酸是一种重要的酸,可用于生产化肥、染料和炸药。工业上利用氮的氧化物、氧气与水反应制备硝酸。
(1)某常见氮的氧化物中N、O两种元素的质量比为7:16,则该化合物的化学式为 。
(2)将该氮的氧化物23.0g与足量的氧气缓慢通入一定量水中(NO x+O 2+H 2O→HNO 3),得到60.0g硝酸溶液溶液的溶质质量分数为多少?(写出计算过程)
取6.5g锌粉于烧杯中,向其中加入稀硫酸至恰好完全反应,共用去稀硫酸154.7g。请计算反应后所得溶液中溶质的质量分数。
市售的某些银首饰是银、锌合金。小庆同学取该合金样品20g,加入100g稀硫酸恰好完全反应,产生气体质量与反应时间的关系如图所示,计算:
(1)该合金中锌的质量(精确到0.1g)。
(2)该稀硫酸中溶质的质量分数(精确到0.1%)。

有一份铜锌合金粉末样品(设只含铜、锌),为认识其组成等,某学习小组进行了以下探究,请参与并完成有关计算:
(1)取样品20g和足量稀硫酸充分混合,待反应完全后过滤,将滤渣洗涤,干燥后称得其质量为13.5g。该样品中铜的质量分数为 。
(2)再取三份不同质量的样品,分别加入到三份100g相同浓度的硫酸溶液中,充分反应后,测得的数据如下表:
| 实验序号 |
① |
② |
③ |
| 样品的质量/g |
10 |
20 |
30 |
| 生成气体的质量/g |
0.1 |
0.2 |
0.25 |
试计算所用硫酸溶液的溶质质量分数(写出计算过程,结果精确到0.01%)。
实验室用碳酸钠溶液与氯化钙溶液反应制取高纯度碳酸钙粉末,烧杯中现有100g碳酸钠溶液,将140g氯化钙溶液分四次加入,充分反应,
注:发生反应的化学方程式为:CaCl2+Na2CO3 ═CaCO3↓+2NaCl
四次测量所得数据如表所示:
次数 |
累计加入氯化钙溶液的质量/g |
烧杯中溶液的总质量/g |
一 |
40 |
135 |
二 |
80 |
170 |
三 |
120 |
205 |
四 |
140 |
225 |
(1)恰好完全反应时,生成沉淀的总质量为 g。
(2)第四次测量时,所得溶液中的溶质有 (填化学式)
(3)计算氯化钙溶液的溶质质量分数(写出计算过程,计算结果保留到0.1%)
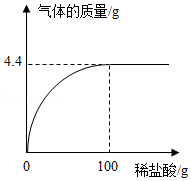
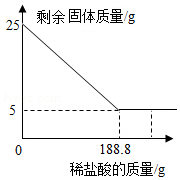
实验室常用大理石和稀盐酸制取二氧化碳。现取25g含碳酸钙的大理石于烧杯中,缓慢加入稀盐酸(大理石中的杂质不溶于水,也不与稀盐酸反应),剩余固体质量与加入稀盐酸的质量关系如图。求:
(1)25g大理石中碳酸钙的质量。
(2)恰好完全反应时所得溶液中溶质的质量分数。
合金是重要的金属材料,常用来制造机械零件、仪表和日用品。某化学研究小组利用黄铜(铜、锌合金)进行了如图所示实验:
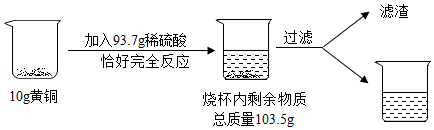
请计算:
(1)生成氢气的质量为 g,黄铜中锌的质量为 g;
(2)过滤后所得溶液的溶质质量分数。
文文想通过实验测定稀盐酸的溶质质量分数,他分四次向182.5g稀盐酸中加入含有杂质的锌粉(杂质不溶于盐酸也不与盐酸发生反应),记录所加锌粉质量与产生氢气的质量如下表所示:
次数 |
1 |
2 |
3 |
4 |
锌粉质量/g |
5 |
5 |
5 |
5 |
氢气质量/g |
0.15 |
0.15 |
0.1 |
0 |
请帮文文计算稀盐酸的溶质质量分数。
化学兴趣小组要测定制作叶脉书签所用氢氧化钠溶液的浓度。取40g该氢氧化钠溶液于锥形瓶中,加入数滴酚酞溶液后再滴加质量分数为10%的稀硫酸,当锥形瓶中液体由红色恰好变成无色时,消耗稀硫酸的质量为49g。试计算该氢氧化钠溶液中溶质的质量分数。
白铜(Cu﹣Ni)是工业上常用的一种合金,金属镍(Ni)的金属活泼性与铁相似,且化合价显+2价。为测定20g某白铜样品中镍的质量,设计了如下实验:

试问:
(1)将白铜研碎的目的是 。
(2)白铜样品中镍的质量 g。
(3)所用稀硫酸中溶质的质量分数(写出计算过程)。
实验室用含杂质的锌(也称粗锌)与盐酸反应制取氢气,取8.0g含杂质的锌粒于烧杯中(所含杂质不溶于水,也不与酸反应),向其中加入73.0g稀盐酸,恰好完全反应后烧杯内剩余物质的质量为80.8g。计算:
(1)生成氢气的质量 g。
(2)求稀盐酸的溶质质量分数(请写出计算过程)。
实验室为了测定过氧化氢溶液的质量分数,称取85.00g H2O2溶液和2.00g MnO2混合放入质量为50.00g的烧杯中,用电子天平称得烧杯的总质量随时间变化如表所示:
时间/S |
15 |
30 |
45 |
60 |
75 |
90 |
烧杯总质量/g |
136.5 |
136.1 |
135.70 |
135.50 |
135.40 |
135.40 |
(1)产生O2的质量为 g。
(2)过氧化氢溶液中溶质的质量分数为?(写出计算过程)
取氯化钡和盐酸的混合溶液100g于烧杯中,向其中滴加碳酸钠溶液,产生气体或沉淀的质量与加入的碳酸钠溶液质量的关系如图所示,请回答:
(1)产生沉淀的质量为 g。
(2)x的值为 。
(3)求所用碳酸钠溶液中溶质的质量分数(请写出计算过程)。

鸡蛋壳的主要成分是碳酸钙。某兴趣小组为了测定鸡蛋壳中CaCO3的含量,取12.5g干燥的鸡蛋壳,捣碎,放在烧杯中,然后向其中滴加某浓度的稀盐酸,滴加过程中产生气体质量与所加稀盐酸质量的关系如图所示(鸡蛋壳中除CaCO3外的其他成分都不溶于水,也不与稀盐酸反应)。试计算:
(1)产生CO2的质量为 g;
(2)该鸡蛋壳中CaCO3的质量分数;
(3)所用稀盐酸溶质的质量分数。