为测定一标签破损(如图)的钙片中碳酸钙的含量,某同学做如图实验:取10片钙片,放入干燥、洁净的烧杯中,然后逐滴滴加稀盐酸,当加入50g盐酸后,恰好完全反应,此时称量烧杯内剩余物质的总质量为65.6g(钙片中其他成分不和稀盐酸反应,反应中产生的气体全部放出).
(1)反应中生成 g二氧化碳,该钙片中碳酸钙的质量分数为 ;
(2)试计算所用稀盐酸中HCl的质量分数.

某校化学兴趣小组在参加社会实践活动时,环保组监测到一湿法冶铜厂排放的废水中含有硫酸和硫酸铜两种污染物,为测定该废水中各污染物的含量,给冶铜厂提供处理废水的参考,环保组的同学进行了以下实验:取废水300g,向其中加入溶质质量分数为20%的氢氧化钠溶液,测得沉淀质量与所加入的氢氧化钠溶液的质量关系如图,请分析计算:
(1)实验中生成氢氧化铜的质量为 g;
(2)300g该废水中硫酸铜的质量;
(3)该废水中硫酸的溶质质量分数。(计算结果精确到0.1%)

某同学在实验室用氯酸钾和二氧化锰的混合物制取氧气,并对反应后固体剩余物进行回收、利用,实验操作流程及数据记录如下

请回答下列问题:
(1)滤液可作化肥使用,你认为它属于 肥;
(2)该同学制得氧气的质量 g;
(3)计算滤液中溶质质量分数。
某同学在实验室用氯酸钾和二氧化锰的混合物制取氧气,并对反应后固体剩余物进行回收、利用,实验操作流程及数据记录如下

请回答下列问题:
(1)滤液可作化肥使用,你认为它属于 肥;
(2)该同学制得氧气的质量 g;
(3)计算滤液中溶质质量分数。
如图所示,往水电解器中加入96g蒸馏水和2g Na2SO4(Na2SO4不参与反应,仅起增加水的导电性的作用)组成的混合物,然后进行电解,当负极得到2g气体时,停止实验(所需相对原子质量:H﹣1、O﹣16).计算:
(1)停止实验时,电解消耗水的质量是多少?
(2)停止实验后,剩余溶液中Na2SO4的质量分数是多少?

向100g硫酸铜与硫酸的混合溶液中加入溶质质量分数为10%的氢氧化钠溶液,溶液质量与所加氢氧化钠溶液的质量关系如图所示,回答下列问题:
(1)由图象可知,c点溶液中的溶质是 。
(2)当加入氢氧化钠溶液的质量为80g时,所得不饱和溶液中溶质的质量分数是多少?(结果精确到0.1%)

向100g硫酸铜与硫酸的混合溶液中加入溶质质量分数为10%的氢氧化钠溶液,溶液质量与所加氢氧化钠溶液的质量关系如图所示,回答下列问题:
(1)由图象可知,c点溶液中的溶质是 。
(2)当加入氢氧化钠溶液的质量为80g时,所得不饱和溶液中溶质的质量分数是多少?(结果精确到0.1%)

实验室有一份部分被氧化成氧化镁的镁粉样品,未知浓度盐酸和40%的氢氧化钠溶液,兴趣小组同学为分析样品中金属镁的质量分数含量和计算盐酸的质量分数,进行如下探究:
(1)用盐酸溶解样品(样品混合均匀),测定生成氢气质量,实验数据如表所示:
实验序号 |
所取样品质量(g) |
所加盐酸质量(g) |
生成氢气质量(g) |
Ⅰ |
16.0 |
60.0 |
0.5 |
Ⅱ |
16.0 |
130.0 |
1.0 |
Ⅲ |
16.0 |
150.0 |
1.0 |
镁粉样品中金属镁的质量百分含量为 。
(2)向实验Ⅲ后的溶液中加入40%的氢氧化钠溶液,生成沉淀的质量随加入氢氧化钠溶液质量的变化关系如图所示。计算盐酸的质量分数。(写出计算过程)

某学校组织社会调查,同学们考察了一家化工企业的污水处理情况。企业技术人员用氢氧化钙粉末对中和池内的296kg污水进行中和处理(污水中的主要污染物是盐酸),测定处理后水样的pH等于7,请回答:
(1)技术人员称量9.0g氢氧化钙粉末,示意图如图所示。请你写出所选砝码的质量 和游码的示数 。
(2)假设上述氢氧化钙与中和池内污水中的盐酸恰好完全反应(污水中的其他成分均不与氢氧化钙反应),计算污水中HCl的质量分数是多少?(写出计算过程)
造纸是我国古代四大发明之一,它极大地推动了人类文明的发展。
(1)践行“习近平生态文明思想”,应积极推广垃圾分类和回收利用。旧报纸应投放到贴有如图 (填字母)标签的垃圾筒内。

(2)为增强纸张的耐磨性,可用玉米淀粉对纸张进行施胶处理。玉米淀粉[(C6H10O5)n,n为正整数]中H、O两种元素的质量比为 (用最简整数比表示)。
(3)造纸会产生大量含NaOH的废水,需处理至中性后排放。环保监测小组取某造纸厂废水样品过滤,为测定滤液中NaOH的质量分数,进行了如下实验:
步骤1:取20.0g滤液于锥形瓶中,滴入几滴酚酞溶液。
步骤2:向锥形瓶中逐滴滴加溶质质量分数为10.0%的硫酸溶液至溶液呈中性,此时溶液呈 色。消耗硫酸溶液3.92g。
计算废水滤液中NaOH的质量分数。(请写出计算过程)
某硫酸厂欲测定排放的废水中硫酸的质量分数(假设废水中只含硫酸一种溶质),取废水样品200g,逐滴加入溶质质量分数为5%的氢氧化钠溶液,废水中硫酸的质量随加入氢氧化钠溶液质量变化如图所示,
(1)要配制100g 5%的氢氧化钠溶液,需氢氧化钠固体质量为 g;
(2)计算该废水中硫酸的质量分数(写出计算过程)。

取含杂质的硫酸镁样品7g(杂质不溶于水,也不参加反应),向其中加入一定量的氢氧化钠溶液(密度为1.06gcm3),恰好完全反应,得到71g溶质质量分数为10%的溶液。计算:
(1)样品中硫酸镁的质量;
(2)所加入的氢氧化钠溶液中溶质的质量分数(计算结果精确到0.1%);
(3)所加入的氢氧化钠溶液的体积(计算结果精确至0.1)。
为测定久置于空气中的氢氧化钠样品的变质程度,某化学活动小组称取该固体样品6.5g放入锥形瓶中,加水溶解,配成50g溶液,再向锥形瓶中滴加稀硫酸,反应过程中产生气体质量的部分实验数据和锥形瓶中溶液质量变化的图象如表所示:
加入稀硫酸的质量/g |
40 |
65 |
75 |
产生气体的质量/g |
1.1 |
2.2 |
2.2 |
(1)6.5g样品与稀硫酸完全反应产生气体的质量是 g。
(2)6.5g样品中碳酸钠的质量分数是 。(结果精确至0.1%)
(3)以上三次的实验数据中,只有一次加入的稀硫酸与锥形瓶中溶液的溶质恰好完全反应。
①如图图象中a的数值是 。
②求该实验中所用稀硫酸的溶质质量分数。(写出计算过程)
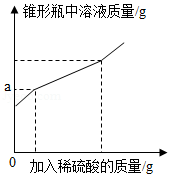
实验室模拟高温煅烧石灰石的方法制取二氧化碳,取35g石灰石样品(假设杂质受热不分解且不与酸反应),煅烧一段时间恢复到室温,测得生成11g二氧化碳。向剩余固体中逐滴加入某盐酸至不再反应为止,又生成2.2g二氧化碳,加入盐酸的质量与生成的氯化钙质量关系如图:
(1)石灰石样品的质量分数是 (结果保留一位小数,下同);
(2)a点溶液的pH 7(填“<”“>”或“=”);
(3)求所加盐酸的溶质质量分数(写出计算过程)。
实验测成分
小伟同学在实验室中对某品牌除锈剂的有效成分及含量进行探究。
(1)定性检验:
小伟同学使用 、 分别与除锈剂反应,通过实验现象确定除锈剂的主要成分是硫酸。
(2)定量测定:
小伟同学利用碳酸钠溶液测定除锈剂中硫酸的质量分数,实验过程如下:
①向烧杯中加入50g除锈剂;
②向除锈剂中滴加碳酸钠溶液,边滴加边搅拌,至不再有气泡放出,共消耗碳酸钠溶液40g;
③反应后,烧杯中剩余物质的总质量为87.8g(除锈剂中其他成分不与碳酸钠反应,反应中产生的气体全部逸出)
根据上述实验数据计算除锈剂中硫酸的质量分数。