溶液在生活、生产中具有广泛的用途。
(1)在20℃时,将20g氯化钾固体加入50g水中,充分搅拌后,仍有3g氯化钾固体未溶解。所得溶液中氯化钾的质量分数为 (计算结果保留一位小数);20℃时氯化钾的溶解度为 。
(2)甲、乙两种不含结晶水的固体物质的溶解度曲线如图。t1℃时,甲溶液的溶质质量分数与乙溶液的溶质质量分数相比,前者与后者的关系是 (填字母)。
A.大于 B.小于 C.等于 D.无法确定
(3)如图是实验室稀释浓硫酸的正确和错误操作,请说明不能将水直接倒入浓硫酸中进行稀释的原因 。


如图是几种固体物质的溶解度曲线。
(1)80℃时,KCl、NH4Cl与NaNO3的溶解度由大到小依次为 。
(2)20℃时,50g水中加入20g NaCl,充分搅拌后,形成 溶液(填“饱和”或“不饱和”)。
(3)60℃时,分别将相同质量的NaCl、NH4Cl与KNO3饱和溶液降温至20℃,析出晶体质量最大的是 。
(4)60℃时,配制KNO3溶液,其溶质质量分数最高不会超过 (精确到0.1%)。
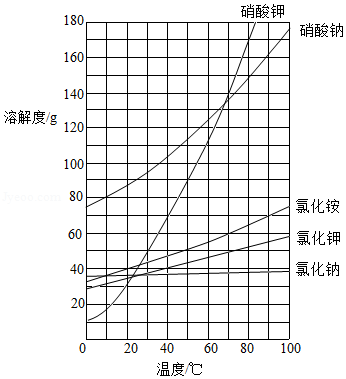
如图是A、B两种物质的溶解度曲线。
(1)0℃时,B的溶解度是 g;t1℃时,A、B的溶解度(S)的大小关系为:SA SB(填“>”、“=”或“<”)。
(2)现有t2℃的A、B的饱和溶液各100g,同时将两份溶液升温至t3℃(不考虑水的蒸发),则此时A、B两溶液的溶质质量分数(a)的大小关系为:ωA ωB(填“>”、“=”或“<”)
(3)现有t2℃的B的溶液100将其蒸发掉10g水,再将温度恢复到t2℃时,析出3gB.若继续蒸发掉10g水,仍将温度恢复到t2℃,此时析出B的质量 3g(填“>”、“=”或“≥”)。
(4)当A中混有少量的B时,提纯A采用的方法是 (填“蒸发结晶”或“降温结晶”)。
(5)现将经提纯的A用于配制一定溶质质量分数的溶液,实验中用到的仪器除了托盘天平(含砝码)、纸片、药匙、烧杯、玻璃棒、试剂瓶、标签外,还需用到的仪器有 。
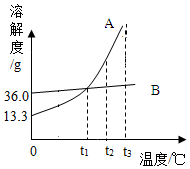
A、B两种固体物质的溶解度曲线如图所示。
(1)t1℃时,A的溶解度是 g。
(2)将t1℃时B的饱和溶液升高温度至t2℃,所得溶液为 (填“饱和”或“不饱和”)溶液。
(3)将t2℃时A的饱和溶液冷却到t1℃,溶液的浓度会 (填“变大”或“不变”或“变小”)。

KNO3和KCl的溶解度曲线如图所示:
(1)t3℃时,KNO3的溶解度为 。
(2)将t3℃时KCl的饱和溶液70.0g稀释成质量分数为20.0%的KCl溶液,需加水 g(精确到0.1g)。查阅相关物质的密度后,在实验室完成该实验通常需要的仪器有烧杯、量筒、 (填字母标号)。
A.托盘天平 B.药匙 C.胶头滴管 D.玻璃棒
(3)现有t2℃时KNO3的饱和溶液m1g和KCl的饱和溶液m2g.不考虑水的蒸发,下列关系一定成立的是 (填字母标号)。
A.两溶液中溶质的质量分数相等
B.分别降温到t1℃,析出KNO3的质量大于析出KCl的质量
C.分别升温至t3℃,所得溶液中溶质的质量分数相等
D.保持t2℃不变,分别加入等质量的水,混匀后所得溶液中溶质的质量分数相等

请根据如图a、b、c三种固体的溶解度曲线,回答下列问题:
(1)P点的含义: 。
(2)若b物质中混有少量a物质,最好采用 的方法提纯b(填“降温结晶”或“蒸发结晶”)。
(3)下列说法正确的是 。
A.将a物质的饱和溶液变为不饱和溶液,其溶质的质量分数一定减少
B.t2℃时,a、b、c三种物质的饱和溶液各100g,所含溶剂的质量由大到小的顺序c>b>a
C.将t1℃时c物质的饱和溶液升温到t2℃,其溶液的质量一定减少

甲、乙、丙三种固体(均不含结晶水)的溶解度曲线如图所示,请回答下列问题:
(I) t2℃时,甲、乙、丙三种物质溶解度大小关系是 。
(2)t3℃时,将20g物质丙加入50g水中充分溶解,井恢复到原温度,所得溶液的质量为 g。
(3)在不改变溶质质量分数的前提下,将甲的不饱和溶液转化为饱和溶液的方法是 。
(4)下列说法正确的是 。
A.甲中混有少量乙时,可用降温结晶的方法提纯甲;
B.t2℃时,甲、丙两物质饱和溶液中所含溶质质量相等;
C.将t3℃时的甲、丙的饱和溶液降低温度至t2℃,溶质的质量分数相等;
D.t1℃时,用甲、乙、丙三种固体配制等质量的饱和溶液,所需水的质量大小关系是乙>甲>丙。

甲、乙、丙三种物质的溶解度曲线如图所示。请回答下列问题:
(1)在 0℃~60℃之间,三种物质中溶解度受温度影响最小的是 。
(2)20℃时,三种物质的溶解度由小到大的顺序为 。
(3)在不改变溶液中溶质的质量分数的前提下,要使接近饱和的丙溶液变为饱和溶液,可采取的一种措施是 。
(4)50℃时,将甲、乙、丙各20 g分别加入盛有50 g水的烧杯中,充分溶解,静置,然后各取上层清液m g,再降温至10℃,此时三种溶液中溶质的质量分数分别为ω(甲)、ω(乙)、ω(丙),则三者之间的大小关系是 。

硝酸钾在不同温度下的溶解度数据如下表所示:
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
| 溶解度/g |
13.3 |
31.6 |
63.9 |
110 |
169 |
回答下列问题:
(1)20℃时,将18g硝酸钾加入到50g水中,充分溶解后,所得溶液的质量是 g。
(2)80℃时,将269g硝酸钾饱和溶液降温到60℃,析出晶体的质量是 g。
(3)0℃时,硝酸钾饱和溶液中溶质的质量分数是 。(结果精确到0.1%)
(4)将40℃的硝酸钾饱和溶液变为不饱和溶液,可采取的措施是 。
某固体物质(不含结晶水)的溶解度曲线如图,M、N两点分别表示该物质在不同温度下的两种溶液,当条件改变时,溶液的状态在图中对应的点的位置可能随之变化,回答下列问题:
(1)M点表示该物质在与t2℃的 (填“饱和”或”不饱和”)溶液。
(2)将M点所示的溶液变到N点所示的溶液,可以将M点的溶液降温至t1℃,过滤除去析出的晶体后,再将溶液升温至 ℃。
(3)t2℃时,若M点所示溶液的质量为70g,其中含溶质 g.再将该溶液降温到t1℃,溶液的溶质质量分数变为 (保留一位小数)。
(4)当恒温蒸发溶剂时,M、N两点的位置变化正确的是 (填字母)
A.M、N点均不动
B.M、N点均垂直上移
C.M点沿曲线下移;N点垂直上移
D.M点不动;N点垂直上移至曲线,不再变动

如图所示为①KNO3②NaCl③H3BO3的溶解度曲线,由图可知:
(1) 当温度为10℃时 ,KNO3、 NaCl 和 H3BO3 三种物质的溶解度由大到小的顺序为 (用序号作答)。
(2) 当温度为t℃时 , 在三种物质的饱和溶液中溶质的质量分数 由 大 到 小 的顺序为 (用序号作答)。
(3)要将P点处的KNO3溶液变成饱和溶液,可采取的措施有:加入KNO3固体、 等(任写一条)。

生命的孕育和维系需要水,人类的日常生活和工农业生产离不开水,水是最常用的溶剂。
(1)电解水实验如图所示。x是电源的 极(填“正”或“负”),检验b试管中所得气体的方法是 。

(2)A、B两种物质的溶解度曲线如图1所示:20℃时,将A、B两种固体各50g,分别加入到盛有100g水的烧杯中,充分搅拌后现象如图2所示;升温到50℃时,A、B两种固体在水中的溶解情况如图3所示,(A、B两物质均不含结晶水)
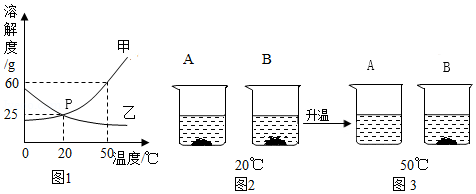
请回答下列问题:
①从20℃到50℃的变化过程中,一直处于饱和状态的是 (填“A”或“B”)的溶液。
②图1中能表示A物质溶解度随温度变化的曲线是 (填“甲”或“乙”)。
③图1中P点的含义 。
④图3中A溶液的溶质质量分数 (精确到0.1%)
如图所示为a、b、c三种固体物质的溶解度曲线,请回答以下问题:
(1)P点是a、c两条曲线的交点,其含义是 。
(2)t2℃时,将a物质20g加入到50g水中,充分搅拌后所得溶液的质量是 g。
(3)t2℃时,将a、b、c的饱和溶液各100g,分别降温至t1℃,所得溶液中溶质的质量分数由大到小的顺序是 。

水是一种重要的资源。请回答下列问题:
(1)下列说法正确的是 (填序号)。
A.软水加入肥皂水容易起浮渣 B.生活中常用煮沸的方法降低水的硬度
C.活性炭在净水中起到吸附作用 D.自来水厂过沉淀、过滤、吸附、消毒等可将泉水变成纯净水
(2)如图所示为X、Y、Z三种固体物质的溶度曲线,请回答下列问题:
①t1℃时,三种物质溶解度的大小关系是 。
②要将t2℃时X的饱和溶液变成不饱和溶液,可采取的措施有:升高温度、 等。
③将t2℃时溶质质量分数为25%的X溶液降温到t1℃,所得溶液中溶质质量分数是 。
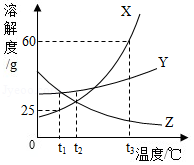
t1℃时,向盛有等体积水的①、②两支试管中分别加入等质量的甲、乙两种可溶性固体,充分溶解后,观察到如图1所示的现象。请回答:
(1)t1℃时, (选填“①”或“②”)试管中的溶液一定是饱和溶液;
(2)图2中表示乙的溶解度曲线的是 (选填“a”或“b”);
(3)下列说法正确的是 。
A、若甲中混有少量的乙,可以采用降温结晶的方法提纯甲。
B.t1℃时,试管①中溶液的溶质质量分数小于试管②中溶液的溶质质量分数
C、保持温度不变,向试管①中加入一定质量的水,溶液中溶质的质量分数一定变大
