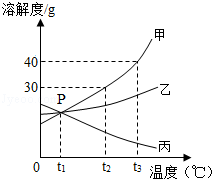
如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,回答下列问题。
(1)P点表示在温度为t1℃时,三种物质的溶解度 。
(2)t2℃时,在温度不变的情况下要将丙的不饱和溶液变成饱和溶液的方法是 (任写一种)。
(3)t2℃时,将25g甲固体加入到50g水中,充分溶解并恢复到原温度后,所得溶液的质量是 g。
(4)t3℃时,三种物质的溶解度由大到小的顺序为 。
(5)将t3℃时丙的饱和溶液降温到t2℃,溶液中溶质的质量分数 (填“变大”、“变小”或“不变”)。
如图是甲、乙、丙三种固体物质在水中的溶解度曲线。下列说法正确的是( )
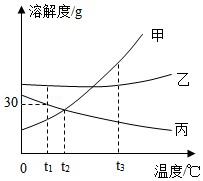
A.t1℃时丙的饱和溶液升温到t3℃变为不饱和溶液
B.t2℃时,甲、丙两种物质的溶解度相等
C.甲中混有少量的乙,可采用蒸发结晶的方法提纯甲
D.t1℃时将20克丙物质溶于50克水中,得到70克溶液
如图是甲乙两种物质的溶解度曲线。下列说法正确的是( )

A.甲的溶解度比乙的溶解度大
B.a2℃时,将30g甲放入50g水中充分搅拌可得80g溶液
C.a1℃时甲、乙两种物质的饱和溶液溶质的质量分数相同
D.将a1℃时甲、乙同种物质的饱和溶液升温至a2℃,溶质的质量分数都增大
KNO3和KCl在不同温度时的溶解度如下表所示:
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
138 |
KCl |
27.6 |
31.0 |
34.0 |
37.0 |
40.0 |
42.6 |
45.5 |
48.3 |
回答下列问题:
(1)20℃时,KCl的溶解度为 g。
(2)依据表中数据,绘制KNO3和KCl的溶解度曲线,如图中能表示KCl溶解度曲线的是 (选填“a”或“b”)。
(3)20℃时,向10g水中加入2.5g KNO3充分搅拌得到X,再加入2.5g KNO3充分搅拌得到Y,继续升温至50℃得到Z,则X、Y、Z中为饱和溶液的是 。
(4)40℃时,现有质量均为100g的硝酸钾和氯化钾两种饱和溶液,若将它们同时降温至10℃.下列说法正确的是 。
A.40℃时,硝酸钾饱和溶液中水的质量大于氯化钾饱和溶液中水的质量
B.降温至10℃时,析出的KNO3晶体质量比析出的KCl晶体质量大
C.降温至10℃时,硝酸钾饱和溶液的质量分数大于氯化钾饱和溶液的质量分数
D.当温度降至20℃和30℃之间的某一温度,两种溶液的质量分数可能相等

某兴趣小组分别用加溶质和恒温蒸发溶剂的方法,将一定质量的硝酸钾不饱和溶液转化为饱和溶液。实验过程中,硝酸钾溶解度的变化情况分别是( )
A.变大 不变B.变大 变小C.不变 变大D.不变 不变
a、b是常见的两种固体物质,根据图表的信息回答下列问题:

物质b的溶解度表
| 温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| b的溶解度/g |
14 |
20 |
30 |
45 |
65 |
85 |
110 |
(1)60℃时,物质a的溶解度是 g;
(2)20℃时,将20g物质b加入到50g水中,充分溶解后得到溶液的质量为 g;
(3)将50℃时a、b两物质的饱和溶液分别降温至20℃,所得溶液的溶质质量分数大小关系为a b(填">"、"="或者"<");
(4)下列说法正确的组合是 (填字母序号)。
①所有物质的溶解度都随温度的升高而增大
②30℃时,物质的溶解度a小于b
③物质b中含有少量a时,可以采用降温结晶的方法提纯b
④40℃时,分别将物质a、b的饱和溶液降温至10℃,析出物质的质量b大于a
A.①④B.①③C.②③D.②④
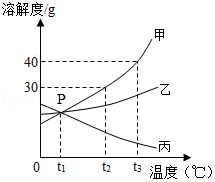
如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,回答下列问题。
(1)P点表示在温度为t1℃时,三种物质的溶解度 。
(2)t2℃时,在温度不变的情况下要将丙的不饱和溶液变成饱和溶液的方法是 (任写一种)。
(3)t2℃时,将25g甲固体加入到50g水中,充分溶解并恢复到原温度后,所得溶液的质量是 g。
(4)t3℃时,三种物质的溶解度由大到小的顺序为 。
(5)将t3℃时丙的饱和溶液降温到t2℃,溶液中溶质的质量分数 (填“变大”、“变小”或“不变”)。
氢氧化钠和碳酸钠的溶解度如表所示。
表:氢氧化钠和碳酸钠溶解度
| 溶剂 |
氢氧化钠 |
碳酸钠 |
|
|
| 20℃ |
40℃ |
20℃ |
40℃ |
|
| 水 |
109g |
129g |
21.8g |
49g |
| 酒精 |
17.3g |
40g |
难溶 |
难溶 |
下列有关分析和推理不正确的是( )
| A. |
氢氧化钠易溶于水和酒精 |
| B. |
温度相同,同种物质在不同溶剂中溶解度不同 |
| C. |
40℃碳酸钠饱和水溶液溶质质量分数为49% |
| D. |
20℃时,将足量二氧化碳通入饱和氢氧化钠酒精溶液中,溶液变浑浊 |
如表是KNO3、NaCl在不同温度下的溶解度:
温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
|
溶解度/g |
KNO3 |
20.9 |
32 |
45.8 |
64 |
85.5 |
110 |
138 |
169 |
202 |
NaCl |
35.8 |
36 |
36.3 |
36.6 |
37 |
37.3 |
37.8 |
38.4 |
39 |
|
根据上表信息,完成下列各题
(1)60℃时,KNO3的溶解度为 。
(2)溶解度受温度的影响较大的物质是 。
(3)10℃时,将KNO3和NaCl的饱和溶液同时升高温度到30℃,所得溶液中溶质的质量分数的大小关系是:前者 后者(填“大于”“小于”或“等于”)。
(4)20℃时,15g NaCl加入到40g水中充分溶解所得溶液的质量为 。
溶液与人们的生产生活密切相关。
(1)下列常见物质不属于溶液的是 (填序号)。
A.生理盐水
B.糖水
C.医用酒精
D.牛奶
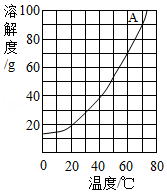
(2)如图是A物质的溶解度曲线,下表是B物质在不同温度时的溶解度。
| 温度/℃ |
B物质溶解度/g |
| 0 |
32 |
| 20 |
35 |
| 40 |
40 |
| 60 |
45 |
| 80 |
55 |
①60℃时,A物质的溶解度是 g。
②50℃时,向100g水中加入40g B物质,充分溶解后得到的是 (填"饱和"或"不饱和")溶液,此时溶液的溶质质量分数是 (结果保留两位小数)。
③请根据表格数据,在A物质溶解度曲线图上绘出B物质的溶解度曲线。
④A、B两种物质溶解度相同时的温度是 ℃。
(3)生活中常用75%酒精消毒液对手和皮肤进行消毒。请分析酒精浓度与杀死细菌的时间对比表(如下)中的数据,酒精消毒液的最合适浓度应为 。根据酒精的物理性质,你认为两者浓度差异的主要原因是 。
| 酒精浓度(%) |
大肠杆菌 |
金黄色葡萄球菌 |
溶血性链球菌 |
| 90 |
15小时 |
30分钟 |
5分钟 |
| 80 |
1小时 |
30分钟 |
5分钟 |
| 70 |
30秒 |
5分钟 |
10秒 |
| 60 |
20秒 |
30分钟 |
10秒 |
| 50 |
20秒 |
2小时 |
20秒 |
| 40 |
22分钟 |
4小时 |
2分钟 |
根据NaCl和KNO3的溶解度数据表,回答下列问题:
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
|
溶解度/g |
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
37.8 |
KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
138 |
|
(1)10℃时,NaCl的溶解度是 g;
(2)30℃时,溶解度较大的是 (选填“NaCl”或“KNO3”);
(3)下列分析正确的是 。
A.10℃时,能够配制出溶质的质量分数为20.9%的KNO3溶液
B.20℃时,20g NaCl固体加入100g水,充分溶解后得到NaCl的不饱和溶液
C.20℃到30℃之间,能配制出溶质质量分数相等的NaCl饱和溶液和KNO3饱和溶液
D.将KNO3溶液经过某种操作后,析出KNO3晶体,过滤后所得溶液溶质的质量分数与原溶液相比,可能变大、变小或不变
某兴趣小组分别用加溶质和恒温蒸发溶剂的方法,将一定质量的硝酸钾不饱和溶液转化为饱和溶液。实验过程中,硝酸钾溶解度的变化情况分别是( )
A.变大 不变B.变大 变小C.不变 变大D.不变 不变
水是生命之源,也是实验室常用的溶剂。
(1)生活中既能降低水的硬度,又能杀菌消毒的方法是 。
(2)含氮物质进入水中会使水质恶化,这里的"氮"是指 (填序号)。
A.原子
B.分子
C.元素
(3)在某温度下,分别向盛有等质量蒸馏水的两烧杯中逐渐加入固体溶质甲和乙,图中x表示所加固体的质量,y表示溶液中溶质与水的质量比。a点对应的乙物质的溶液为 (选填"饱和"或"不饱和")溶液;该温度时甲物质的溶解度为 g。

请根据如图甲、乙、丙三种固体物质的溶解度曲线,回答下列问题。
(1)在 ℃时,甲、丙两种物质的溶解度相等;
(2)在t2℃时,向盛有25g甲物质的烧杯中加入50g水,充分溶解后,所得溶液的溶质质量分数为 。
(3)若乙物质中混有少量甲物质,最好采用 (填“降温结晶”或“蒸发结晶”)的方法提纯乙;
(4)t2℃时,甲、乙、丙三种物质的饱和溶液各100g,所含溶剂的质量由大到小的顺序是 。
