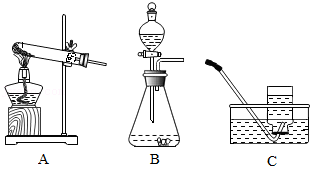
氧气是人类活动的必需的物质之一,下列与氧气有关的实验装置图错误的是( )
| A. |
|
B. |
|
| C. |
|
D. |
|
家庭医药箱里有一瓶标签缺损的医用双氧水,为测定其溶质质量分数,小宁设计了如图实验:在试管中放入一定量的二氧化锰,然后用注射器注入10mL该医用双氧水,直到试管中不再有气泡产生,通过测量量筒内水的体积就可以大致计算出双氧水质量分数。
(1)实验中用排水法测量氧气的体积是因为氧气具有 的性质。
(2)若俯视读得量筒中水的体积,则测得的双氧水质量分数将 (填“偏大”“偏小”或“不变”)。

根据下列装置图,回答问题:
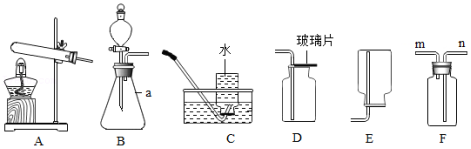
(1)仪器a的名称是 。
(2)实验室某小组选取B装置作为发生装置制取氧气,则反应的化学方程式为 。
(3)若选取F装置,采用排空气法收集氧气,氧气应从 端(填“m”或“n”)通入。
根据下列实验装置图回答问题。
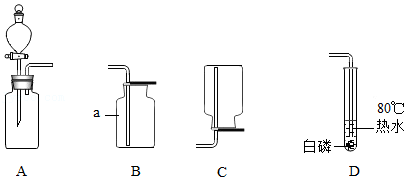
(1)写出标有字母a的仪器名称: 。
(2)实验室用装置A制取氧气的化学方程式为 。
(3)如图中装置 (填字母)可用来收集氧气。
(4)将反应生成的氧气通入D中,使其接触底部的白磷后,看到的现象是 ,说明可燃物燃烧需要的条件之一是 。
观察实验现象,得出实验结论。
(1)如图所示为实验室用过氧化氢溶液和二氧化锰的混合物制取氧气。写出:

①仪器a的名称 。
②用向上排空气法收集氧气的理由是 。
③该反应的化学方程式为 。
④检验氧气是否集满的方法是 。
⑤红磷在空气中燃烧的现象是 ,发生反应的化学方程式为 。
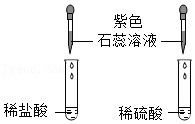
(2)如图描述的是:酸溶液使指示剂变色的实验,发现紫色石蕊溶液均变为红色,产生这一现象的根本原因是这两种酸溶液都含有 。
(3)在探究影响溶质溶解快慢的因素,比较等量硫酸铜在水中溶解的快慢时,设计并进行了如下实验:
实验 |
实验1 |
实验2 |
实验3 |
完全溶解所需时间/s |
60 |
35 |
55 |
请你回答下列问题:
①对比实验1和实验2的现象,可以得出的结论是 。
②设计实验2和实验3进行对比实验的目的是 。
(4)化学课上,教师按图甲所示的装置进行实验,得到图乙所示的现象。用初中阶段所学化学知识不能解释的现象是 ,由此可见,人们对事物的认识是一个不断完善和提高的过程。

实验室常用溶质质量分数为6%的H2O2溶液(MnO2作催化剂)制取少量氧气。
(1)配制6%的H2O2稀溶液
①计算:市售H2O2溶液溶质质量分数通常为30%。配制100g 6%的H2O2溶液,需要30%的H2O2溶液质量为 g。
②配制:量取所需H2O2溶液和水于烧杯中,用 (填仪器名称)搅拌,充分混合。
(2)制取氧气(可能用到的部分装置如图)
①实验室用H2O2制取氧气的化学方程式为 ,可选择的发生装置为 (填字母)。
②若用C装置干燥氧气,则C中盛放的试剂为 。
③若用D装置收集氧气,则气体应从导管 (填“a”或“b”)端通入。
(3)拓展延伸
若直接用30%的H2O2溶液制取氧气,反应速率太快。为获得平稳的气流,如图所示发生装置能达到最佳效果的是 (填字母)。

O2是人类生活不可缺少的物质,制取O2的方法很多。请回答下列问题:
(1)KMnO4分解法:该反应的化学方程式为 ;
(2)KClO3分解法:应选用图中的 (填图中装置对应的字母)作发生装置;
(3)H2O2分解法:常温下H2O2分解缓慢,通常加入少量MnO2,则MnO2的作用为 ;
(4)可以用C所示装置来收集O2,体现了O2 的性质;
(5)已知N2的沸点为﹣196℃,O2的沸点为﹣183℃。工业上在低温下加压,先使空气液化,然后蒸发,则O2为 (填“先”或“后”)蒸发出来的气体。
探究氧气的实验室制取和性质。
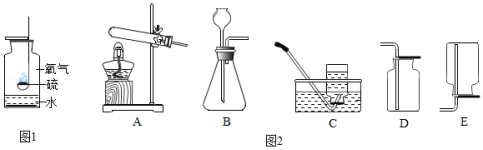
(1)如图1是硫在氧气中燃烧的实验。
①观察到火焰的颜色是 ;
②反应的化学方程式是 ;
③当火焰变得微弱时,将燃烧匙进一步伸入瓶底,火焰又变旺,可得出氧气的一条物理性质是 。
(2)图2是实验室制取气体的部分装置。
①实验室用高锰酸钾制氧气的化学方程式是 ,选择的发生装置是 (填字母序号,下同);还可用过氧化氢溶液和二氧化锰制氧气,选择的发生装置是 。
②可以选择装置C收集氧气,其原因是 。
③可见,选择气体的发生装置要依据反应物的状态和 ,选择气体的收集装置要依据 。
掌握常用仪器的特征和用途,积极动手实验,是化学学习和研究的基础。图甲为实验室用高锰酸钾制取氧气的装置。
(1)取一定量的高锰酸钾粉末装入试管中,应选择的仪器是 (填字母)。
A.药匙
B.镊子
C.玻璃棒
(2)图甲中收集氧气所采用的方法是 法。
(3)加热试管时,先使酒精灯火焰在试管下方 ,让试管均匀受热,然后对准高锰酸钾所在部位加热。
(4)检验氧气是否集满的正确操作是图乙中的 (填字母)。

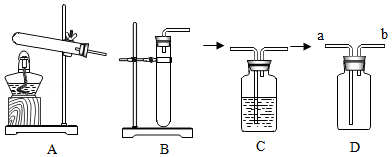
如图所示是初中化学实验室制备气体的发生装置和收集装置,请根据题意回答下列问题:

(1)写出图中标号仪器①的名称 。
(2)若使用高锰酸钾制氧气,发生反应的化学方程式为 ,可选用的发生装置是 (填字母),如用E装置来测定制得氧气的体积,植物油上方的空气对实验结果 (填"有影响"或"无影响")。
(3)实验室制取二氧化碳时,发生反应的化学方程式为 ,某同学为了能控制反应的发生和停止,选择C装置来制二氧化碳。小组同学讨论后发现此装置有一处错误需改正后才能进行实验,该错误是 。改正后制得的二氧化碳如用D装置收集,应从 (填a或b)端通入。
请根据如图实验装置,回答问题。

(1)写出仪器a的名称 。
(2)若实验室用氯酸钾和二氧化锰共热制取氧气,选用的发生装置和收集装置是 ,写出该反应的化学方程式 。
(3)将B制取的气体通入G装置,探究燃烧的条件。观察到Y型管左边的白磷燃烧,右边的白磷不燃烧,可探究出燃烧所需的条件是 。
(4)若用B、F装置制取二氧化碳。当观察到 时,证明二氧化碳收集已满;若F装置中没有出现上述现象。其可能原因是 。(写一个)
化学小组的同学利用如图仪器和装置完成以下实验。

(1)制取氧气。
①指出图中标号仪器的名称:X 。
②高锰酸钾和过氧化氢溶液均可用于实验室制取氧气。加热高锰酸钾制取氧气,可选用的发生装置是 (填字母序号,下同),收集装置是 。
③选用B作为发生装置,用过氧化氢和二氧化锰制取氧气。该反应的化学方程式是 。实验时的主要操作步骤有:a.向分液漏斗中加入过氧化氢溶液;b.收集气体;c.检查装置的气密性;d.向锥形瓶中加入二氧化锰;e.组装仪器。以上步骤正确的操作顺序是 (填字母序号)。
(2)制取二氧化碳。用大理石与稀盐酸反应制取二氧化碳的化学方程式是 。反应后的废液中如果含有稀盐酸不能直接排放,以免污染环境。请你选择下列试剂设计一种实验方案,检验废液中是否含有稀盐酸。
可供选择的试剂;石灰石、硝酸银溶液、紫色石蕊试液、氢氧化钠溶液
| 实验操作 |
现象与结论 |
|
|
|
利用下列装置进行气体的制取实验,请问答下列问题:
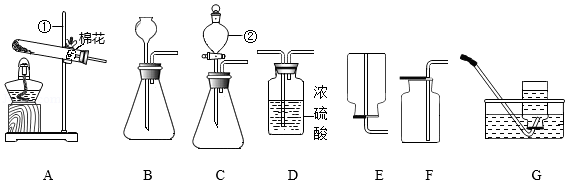
(1)写出仪器的名称:① ② 。
(2)实验室用过氧化氢溶液制取氧气时,若要制取一瓶干燥的氧气,必须使气体通过 (填字母,下同)装置,选用装置 收集,验满的方法是 。
(3)实验室用加热高锰酸钾固体的方法制取较纯净的氧气,选用发生装置 和收集装置G组合,检查该装置气密性的方法是:连接好仪器,把导管的一端浸入水中, ,证明装置连接完好、不漏气。
(4)实验室用电石固体与饱和食盐水常温下反应制取乙炔(C2H2)气体,同时有糊状 Ca(OH)2生成,发生装置选用C而不选用B的原因是 ;乙炔充分燃烧的化学方程式为 。
(1)如图为实验室制取并收集气体的装置图,回答下列问题。
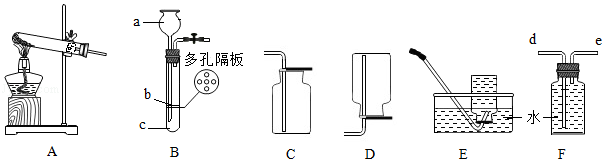
①a仪器的名称是 。
②实验室用高锰酸钾制取并收集干燥的氧气应选用的装置组合是 (填序号)。
③若用F装置收集并测量氧气的体积,应在 (填“d”或“e”)端连接量筒。
④实验室制取二氧化碳的化学方程式是 ,用B装置制取二氧化碳便于控制反应的发生与停止,制取时应将大理石放在 (填“b”或“c”)处。
(2)某化学兴趣小组在学完金属活动性顺序相关知识后,他们做了钠与硫酸铜溶液反应的实验,发现并没有铜生成,而是产生蓝色絮状沉淀和少量黑色物质。于是他们进行了如下探究:
【实验探究1】取一块绿豆大小的金属钠,放入盛有20mL蒸馏水的烧杯中,发现金属钠浮在水面上,熔化成一个闪亮的小球并四处游动,发出嘶嘶的响声,收集反应产生的气体,发现该气体能燃烧。
【实验探究2】在上述反应所得溶液中滴加硫酸铜溶液,产生蓝色絮状沉淀。
【实验探究3】将蓝色絮状沉淀加热得到黑色固体。
【查阅资料】①钠在常温下能与水剧烈反应,生成一种碱和一种气体。②氢氧化铜受热易分解。③氧化铜为黑色固体。
【问题分析】①写出钠与水反应的化学方程式 ,点燃反应产生的气体前应该先 。②写出产生蓝色絮状沉淀的化学方程式 。
【实验结论】在金属活动性顺序中,活动性较强的金属 (填“一定”或“不一定”)能将位于其后面的金属从它们的盐溶液中置换出来。
【反思与交流】钠与硫酸铜溶液反应产生少量黑色物质的可能原因是 。
(1)如图为实验室制取并收集气体的装置图,回答下列问题。

①a仪器的名称是 。
②实验室用高锰酸钾制取并收集干燥的氧气应选用的装置组合是 (填序号)。
③若用F装置收集并测量氧气的体积,应在 (填“d”或“e”)端连接量筒。
④实验室制取二氧化碳的化学方程式是 ,用B装置制取二氧化碳便于控制反应的发生与停止,制取时应将大理石放在 (填“b”或“c”)处。
(2)某化学兴趣小组在学完金属活动性顺序相关知识后,他们做了钠与硫酸铜溶液反应的实验,发现并没有铜生成,而是产生蓝色絮状沉淀和少量黑色物质。于是他们进行了如下探究:
[实验探究1]取一块绿豆大小的金属钠,放入盛有20mL蒸馏水的烧杯中,发现金属钠浮在水面上,熔化成一个闪亮的小球并四处游动,发出嘶嘶的响声,收集反应产生的气体,发现该气体能燃烧。
[实验探究2]在上述反应所得溶液中滴加硫酸铜溶液,产生蓝色絮状沉淀。
[实验探究3]将蓝色絮状沉淀加热得到黑色固体。
[查阅资料]①钠在常温下能与水剧烈反应,生成一种碱和一种气体。②氢氧化铜受热易分解。③氧化铜为黑色固体。
[问题分析]①写出钠与水反应的化学方程式 ,点燃反应产生的气体前应该先 。②写出产生蓝色絮状沉淀的化学方程式 。
[实验结论]在金属活动性顺序中,活动性较强的金属 (填“一定”或“不一定”)能将位于其后面的金属从它们的盐溶液中置换出来。
[反思与交流]钠与硫酸铜溶液反应产生少量黑色物质的可能原因是 。