纳米碳酸钙是一种重要的无机化工产品,下图是某厂生产纳米碳酸钙的工艺流程。
请回答下列问题:
(1)请完成并配平该工艺中生成CaCO3固体的反应方程式:
CaCl2+_________+CO2 CaCO3↓+__________+H2O
CaCO3↓+__________+H2O
(2)若在实验室中进行该实验,操作l的名称是 ,使用到的玻璃仪器有玻璃棒、________、_________,其中玻璃棒的作用是 。
(3)操作2为洗涤、干燥,其中洗涤的目的是除去碳酸钙粗品表面含有的可溶性杂质,其中一定含有的可溶性杂质是 ,检验是否洗涤干净的方法是向最后一次洗涤液中加入 溶液(①Ca(OH)2 、② AgNO3、③ CaCl2,填写序号),如果没有出现沉淀,说明已经洗涤干净。
(4)上述流程中的副产品(NH4Cl)可用作_____________________。(写一种用途)
老师为同学们提供了如下实验装置:
(1)写出仪器a名称: .
(2)实验室用加热高锰酸钾制取氧气时采用A装置作发生装置,写出高锰酸钾制取氧气的化学反应方程式______________________________。 若要收集一瓶氧气,供“硫在氧气中燃烧”实验使用,最好选择的气体收集装置是F,理由是①____________________,②_____________________。
(3)实验室制取二氧化碳发生装置可选用装置B或装置C,装置C与装置B相比,装置C优点是 。二氧化碳的收集装置是_____(填装置字母),实验室制取二氧化碳的化学方程式为 。
(4)甲烷化学式为 CH4,甲烷密度比空气小、难溶于水,CH4可以用下图装置收集,请填写进气管的字母代号:
若用图1装置收集,CH4从 端通入;若用图2装置收集,CH4从 端通入。
化学实验是科学探究的重要途径。请根据下列实验图示回答相关问题:
(1)A实验中,烧杯③的作用是 。
(2)B实验中,硬质玻璃管中的现象是 ;装置末端酒精灯的作用是 。
(3)C实验中,若要除去粗盐中难溶性的杂质,其正确操作步骤为 (填序号);若按照②③①的步骤配制50 gl6%的氯化钠溶液,所配制溶液的溶质质量分数
(填“偏小”或“偏大”)。
如果配制6%的氯化钠溶液的溶质质量分数偏小,其原因是
| A. | 称取的氯化钠固体质量偏大 |
| B. | 转移称量好的氯化钠同体时,有少量洒落在桌面上 |
| C. | 量取水的体积偏小 |
| D. | 转移配制好的溶液时,有少量液体溅出 |
结合图示实验装置,回答下列问题。
(1)图中a、b仪器的名称:a ,b 。
(2)用高锰酸钾固体制氧气,选用的发生装置是_________(填“A”、“B”或“C”),装入药品前应先 ;如用D装置收集O2,则气体收集完毕时,应先 (填“从水中取出导气管”或“熄灭酒精灯”)。
(3)实验室制取二氧化碳时,如用E装置收集CO2,则气体应从______端通入(填“c”或“d”)。
(4)用块状固体和液体不加热制取气体时,改用C装置(多孔隔板用来放块状固体)代替B装置的优点是 (答出一点即可)。
关于实验基本操作方法的归纳错误的是
| A.点燃可燃性气体之前必须检验气体的纯度 |
| B.制取气体时应先检验装置的气密性再装药品 |
| C.氢气还原氧化铜完毕,应先熄灭酒精灯继续通氢气到试管冷却 |
| D.蒸发操作时,蒸发皿必须放在石棉网上,用酒精灯外焰加热 |
下列实验装置进行的相应实验,达不到实验目的是
| A.用图1所示装置除去CO2中含有的少量HCl气体 |
| B.用图2所示的装置加热蒸发NaCl饱和溶液制备NaCl晶体 |
| C.用图3所示装置制取少量CO2气体 |
| D.在实验室中,用图4所示装置除去少量黄河水中的泥沙 |
铜跟浓硫酸的反应原理是: ↑。某小组同学用下图所示装置制取硫酸铜。请回答以下问题:

(1)图中
装置用来收集
(已知
的密度大于
的密度),但未将导管画全,请在答题纸上将
装置中的导管补画完整。
(2)图中
装置的作用是防止氢氧化钠溶液倒吸入
瓶中,装置
的作用是.
(3)充分反应后,烧瓶中的铜片仍有剩余,那么硫酸是否也有剩余呢?该小组同学进一步研究:待烧瓶冷却后,将烧瓶中的混合物稀释、过滤,用滤液做了如下实验。
实验1:用
试纸测试滤液
,其
约为1;
实验2:取少量滤液于试管中,向试管中滴加氯化钡溶液,有白色沉淀现象。
你认为,可说明硫酸有剩余。(选填"实验1"或"实验2")
(4)以铜片与浓硫酸为原料用上述方法制取硫酸铜,存在的缺陷有(答出两点即可。)
下图是实验室中用于制取气体、验证性质的装置图,请回答下列问题:
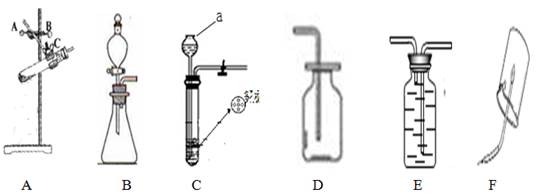
(1)图C仪器a名称
(2)若选用A装置加热氯酸钾和二氧化锰的混合物制取氧气,化学方程式: ,所缺仪器是的名称 ,需调节该装置旋钮 ,使 。
(3)若用D装置收集二氧化碳,验满的方法是 。
(4)先用 E 装置收集氢气,则气体从 进(填“长管”或“短管”),然后验证其性质,如图F,观察到火焰的颜色为 。
(5)某同学用二氧化锰粉末和过氧化氢溶液制取氧气,化学方程式为: 。若用A装置,发现反应过于剧烈,不易控制,此时可以选择 装置获得平稳的氧气流。若用所选装置与装置E连接,加入13.6g一定质量分数的过氧化氢溶液制取氧气,理论上应收集2.2L氧气,而实际收集到氧气的体积约为3.2L,这是因为 。
正确的实验操作对实验结果、人身安全都非常重要。下列实验操作正确的是
| A.点燃酒精灯 | B.滴加液体 | C.过滤河水 | D.检查装置气密性 |
焦亚硫酸钠(Na2S2O5)是一种常用的食品抗氧化剂,小金模仿化工生产,用如图装置来制取Na2S2O5。
已知:A中发生的反应为:H2SO4(浓)+Na2SO3═Na2SO4+SO2↑+H2O
B中发生的反应为:Na2SO3+SO2═Na2S2O5

(1)图中盛放浓硫酸的仪器名称是 ;
(2)写出C中发生反应的化学方程式 ;
(3)在实验过程中,滴加浓硫酸不宜过快,理由是 。
(4)该实验开始滴加浓硫酸时,应先除尽装置内的空气,若忘记这一操作,新制取的Na2S2O5产品中会混有Na2SO4杂质,这与O2的 有关(填化学性质)
实验室用高锰酸钾制取氧气,请结合下列装置,回答问题:
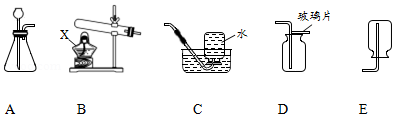
(1)写出仪器X的名称: ;
(2)要制备较为纯净的氧气,应选用的发生装置和收集装置是 (填序号),该反应的化学方程式为 ;
(3)该实验的主要步骤有:①将导气管移出水槽;②加热;③装药品、棉花;④收集;⑤熄灭酒精灯;⑥检查装置气密性。正确的操作顺序为 。
某同学在配制50g溶质量分数为5%的食盐溶液的实验中,称量时将砝码放在左盘(1g以下用游码),食盐放在右盘;量水时仰视液面读数,这样配制的食盐溶液中的质量分数
| A.等于5% | B.大于5% | C.小于5% | D.不能确定 |