除去下列物质中所含少量杂质,所用除杂试剂和操作方法正确的是( )
| |
物质 |
所含杂质 |
除杂试剂 |
操作方法 |
| A |
CO 2 |
CO |
﹣﹣ |
点燃 |
| B |
NaCl溶液 |
Na 2CO 3 |
Ca(NO 3) 2溶液 |
过滤 |
| C |
氯化钾固体 |
二氧化锰 |
水 |
加水溶解后,过滤、蒸发 |
| D |
CaCO 3固体 |
CaO 固体 |
﹣﹣ |
高温、灼烧 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
下表中除去物质中少量杂质的方法正确的是( )
选项 |
物质 |
所含杂质 |
除去杂质的方法 |
A |
氯化钠 |
泥沙 |
加入适量水溶解、过滤、洗涤、干燥 |
B |
氮气 |
氧气 |
将混合气体通过灼热的铜网 |
C |
木炭 |
四氧化三铁 |
将混合物在空气中灼烧 |
D |
氢氧化钠溶液 |
氢氧化钙 |
加入过量的碳酸钠溶液,充分反应后,过滤 |
A.AB.BC.CD.D
要除去下列各物质中少量杂质,所选试剂和方法正确的是( )
| 选项 |
物质 |
杂质 |
除杂试剂和方法 |
| A |
CO 2 |
CO |
通入氧气,点燃 |
| B |
KCl溶液 |
KNO 3 |
加入适量的AgNO 3溶液,过滤 |
| C |
FeSO 4溶液 |
CuSO 4 |
加足量的铁粉,充分反应后过滤 |
| D |
MnO 2 |
炭粉 |
在空气中充分灼烧 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
除去如表物质中的少量杂质所选用的方法正确的是( )
| 选项 |
物质(杂质) |
方法 |
| A |
NaCl(泥沙) |
溶解、过滤、洗涤、干燥 |
| B |
K 2SO 4溶液(MgSO 4) |
加入适量的KOH溶液,过滤 |
| C |
CO 2(O 2) |
将混合气体通过灼热的铜网 |
| D | Fe(CuO) |
将固体加热,通入CO |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
如表中除去物质中少量杂质的方法错误的是( )
| 选项 |
物质 |
所含杂质 |
除去杂质的方法 |
| A |
铜粉 |
铁粉 |
用磁铁吸引 |
| B |
二氧化碳 |
氯化氢 |
通过足量的氢氧化钠溶液 |
| C |
硫酸钠溶液 |
碳酸钠 |
加入适量稀硫酸 |
| D |
碳酸钙 |
氯化钙 |
加适量的水溶解、过滤、洗涤、干燥 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
为了适应各种不同的需要,常常要把混合物进行提纯:
(1)含有泥沙的粗盐可通过溶解、 、蒸发等处理,得到初步提纯.其中在蒸发操作中玻璃棒的作用是 ,当蒸发皿中 时,停止加热.
(2)除去铜粉中混有的少量铁粉,可采用的物理方法是 ,除去氢氧化钠溶液中的碳酸钠,可以加入适量的 溶液,然后过滤.
除去下列各物质中少量杂质,所选用的试剂和操作方法均正确的是( )
| 选项 |
物质(括号内为杂质) |
试剂 |
操作方法 |
| A |
CaCO 3(CaO) |
无 |
高温 |
| B |
H 2O(植物油) |
洗涤剂 |
振荡、搅拌 |
| C |
CuO(铜粉) |
足量氧气 |
灼烧 |
| D |
KCl(KClO 3) |
二氧化锰 |
加热 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
下标中除去物质中少量杂质的方法错误的是( )
| 选项 |
物质 |
所含杂质 |
除杂质的方法 |
| A |
二氧化碳 |
水蒸气 |
通入浓硫酸 |
| B |
盐酸 |
硫酸 |
适量的氯化钡溶液,过滤 |
| C |
氢氧化钠溶液 |
碳酸钠 |
过量的石灰水,过滤 |
| D |
氯化钠 |
泥沙 |
加水溶解、过滤、蒸发 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
除去下列物质中少量杂质所加入试剂合理的是( )
| 选项 |
物质 |
所含杂质 |
除去杂质所加试剂 |
| A |
Ca(OH) 2 |
CaCO 3 |
盐酸 |
| B |
MgCl 2 |
NaCl |
硝酸银溶液 |
| C |
C |
Fe |
稀硫酸 |
| D |
CO 2 |
HCl |
氢氧化钠溶液 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
NaCl、CaCl 2的部分溶解度数据见下表。
| 温度(℃) |
20 |
40 |
60 |
80 |
100 |
|
| 溶解度 (g/100g水) |
NaCl |
36.0 |
36.6 |
37.1 |
38.0 |
39.2 |
| CaCl 2 |
27.6 |
39.8 |
41.4 |
43.2 |
45.2 |
|
①由上表可知:20℃时,NaCl的溶解度是 g/100g水;60℃时,溶解度相对较大的物质是 。
②某NaCl固体中含有CaCl 2杂质,分别取样进行实验。
【测定杂质含量】
取10.0g样品溶于水,加入足量Na 2CO 3溶液,与CaCl 2反应生成NaCl和0.01mol CaCO 3沉淀,计算样品中CaCl 2的质量。(根据化学方程式列式计算) 。
【提纯NaCl】取30g样品,依据两种物质的溶解度差异设计实验并提纯NaCl。
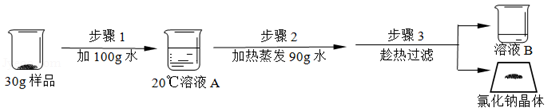
Ⅰ.溶液A是NaCl的 (选填"饱和"或"不饱和")溶液;
Ⅱ.溶液A中CaCl 2的质量分数 (选填"大于""小于"或"等于")溶液B中CaCl 2的质量分数;
Ⅲ.为达成实验目的,上述三个步骤在试剂用量、实验操作等方面都有综合考虑,请写出其设计意图 。
下列实验设计能达到实验目的是
| 选项 |
实验目的 |
实验设计 |
| A |
除去食盐中少量的硫酸钠 |
溶解,过滤 |
| B |
除去氮气中的少量氧气 |
将气体通过灼热的铜网 |
| C |
鉴别硬水和软水 |
观察样品颜色 |
| D |
鉴别稀盐酸和氢氧化钾溶液 |
|
下列除杂方法正确的是( )
| 选项 |
物质(括号内为杂质) |
方法 |
| A |
K 2 CO 3 溶液( K 2 SO 4 ) |
加 BaCl 2 溶液,过滤 |
| B |
N 2 ( O 2 ) |
将气体通过灼热的铜网 |
| C |
NaOH 溶液( Na 2 CO 3 ) |
加入稀硫酸 |
| D |
ZnSO 4 溶液( CuSO 4 ) |
加入过量的铁粉,过滤 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
(1)化学兴趣小组的同学欲除去某FeCl2溶液中混有的CuCl2杂质,实验操作步骤如下:
①在混合溶液中加入过量的 粉(只有一个正确选项,选填字母),搅拌,使其充分反应:
A.铁 B.铜 C.银
②过滤,得到FeCl2溶液和金属混合物.
(2)该小组同学欲继续探究上述②得到的金属混合物中Cu的质量分数,将该金属混合物洗涤、干燥,称得其质量为28.0g.向此金属混合物中逐滴滴加稀盐酸,产生氢气的质量与加入稀盐酸溶液的质量关系如图所示,完成下列问题:
①计算该金属混合物中Cu的质量分数.(请根据化学方程式写出完整的计算步骤)
②该实验中,有同学认为还可以通过测定其他数据来计算Cu的质量分数,实验时他需要测定的实验数据应是 .

绍兴市获得2015年度全省“五水共治”工作优秀市并被授予大禹鼎,“五水共治”是指治污水、防洪水、排涝水、保供水、抓节水,还社会一个蓝天碧水,为百姓创造美好的生活环境。
某化工厂流程会产生澄清废水,其中可能含有的离子是Ag+、Cu2+、Cl﹣、NO3﹣,已知:白色的沉淀Fe(OH)2在空气中会迅速转化为红褐色的Fe(OH)3。
(1)取少量废水,加入过量稀盐酸,产生白色沉淀;再加入过量氢氧化钠溶液,产生蓝色沉淀。该废水中含有的金属离子是 。
(2)兴趣小组设计了一个除去该废水中原有金属离子的实验方案,部分流程如图所示。操作I的名称是 ,单质A是 。
