物质发生化学变化的前后,总质量是否发生改变?是增加、减小还是不变呢?甲、乙、丙三位同学按下面的步骤进行探究:
(1)提出假设:物质发生化学变化前后总质量不变。
(2)设计并进行实验,甲设计的实验装置和选用药品如图A所示,乙设计的实验装置和选用药品如图B所示,他们在反应前后都进行了规范的操作,准确的称量和细致的观察。
写出A、B两个实验发生反应的化学方程式: ① , ② 。
丙进行了图C所示的实验,在一根用细铜丝吊着的长玻璃棒两端,分别绕上粗铜丝,并使玻璃保持水平。然后,用酒精灯给a端铜丝加热数分钟。停止加热后冷却,他观察到的现象是 ③ , ④ 。
(3)实验结论:
甲认为:在化学反应中,生成物的总质量与反应物的总质量相等;
乙、丙认为:在化学反应中,生成物的总质量与反应物的总质量不相等。
(4)你认为 ⑤ 的结论正确,请从原子的角度分析,结论正确的理由是: ⑥ 。
(5)导致其他实验结论错误的原因是 ⑦ , ⑧ 。因此,如果 ⑨ 的反应,则一定要设计反应在密闭装置中进行。
为探究铁锈蚀的影响因素,某兴趣小组做了如下实验。
[实验方案] 将3枚洁净的铁钉同时置于如图所示环境下的试管中,观察铁钉锈蚀情况。
[实验现象]3天后,I、Ⅲ中铁钉不生锈,Ⅱ中铁钉明显生锈。
[获得结论]
(1)对照实验l、Ⅱ,可知铁锈蚀的条件之一为 ;
(2)防止铁锈蚀的一种方法是 。
[拓展探究]
(3)小明发现海边的铁器很容易生锈,从而猜测氯化钠能加快铁的锈蚀。请设计实验方案验证小明的猜想 。
某兴趣小组的同学对一包久置的生石灰(CaO)干燥剂产生了好奇,于是他们对这包干燥剂的成分展开了探究。
【提出问题】这包干燥剂是否变质,成分是什么?
【猜想假设】猜想一:全部是CaO; 猜想二:是CaO和Ca(OH)2的混合物;
猜想三:全部是Ca(OH)2; 猜想四:是Ca(OH)2和CaCO3的混合物。
【实验探究】(1)取部分该干燥剂于试管中,加水后无放热现象,说明这包干燥剂中不含 。
(2)继续向试管中滴加足量稀盐酸,有气泡出现,说明这包干燥剂中含有 。
(3)为了进一步确定这包干燥剂中有无其他成分,小组同学设计了以下三种方案。
另取部分干燥剂于烧杯中,加水并搅拌,静置后取上层清液于3支试管中。请你参与实验,并填写表中的空白:
写出方案二发生的化学反应方程式 。
【实验结论】通过以上实验探究,得出猜想 成立。
【拓展迁移】小组同学反思了生石灰干燥剂变质的原因,认识到实验室保存氧化钙应注
意 。
某同学做“证明鸡蛋壳的主要成分是碳酸盐,并收集纯净的气体”的实验。设计了如下方案进行实验:
A B C D E
(1)写出所标仪器的名称:① 、② 。
(2)描述A中发生的现象: 。
(3)根据我们所学的知识,你认为A装置和 装置相连并产生什么现象时就足以说明鸡蛋壳的主要成分是碳酸盐? ;写出该装置中发生反应的化学方程式: 。
(4)该同学想要收集一瓶纯净的该气体,进一步验证它的性质。连接上述装置的顺序是:(填写各接口字母) 。其中,C装置的作用是: ;写出有关反应的化学方程式: 。
(5)写出用A装置还可以制取的日常生活中一种常见气体的化学反应方程式: 。并说出它的一个重要用途 。
某实验小组的同学用碳酸钠粉末、粒状大理石、稀盐酸、浓盐酸、稀硫酸这几种药品,探究哪两种药品的反应适合在实验室制取
气体。请你参与下列的探究并回答问题。
[提出问题]上述酸和碳酸盐的反应是否适合在实验室制取
气体。
[方案设计]大家经过讨论,一致认为浓盐酸不适合用于实验室制取
气体,原因是浓盐酸挥发出的
气体混于
中,使制得的气体不纯。小明设计了下图装置来除去
中
,

洗气瓶中盛装的液体可以是(填序号)
①浓硫酸 ②碳酸氢钠溶液
③氢氧化钠溶液 ④澄清石灰水
[实验与结论]
该小组设计了三个实验进行对比

(1)请你填写实验C的实验现象和实验结论
| 实验 |
实验现象 |
实验结论 |
| A |
剧烈反应,迅速放出大量气体 |
反应速度过快,气体不便收集,不宜用于实验室制取 |
| B |
产生气泡,速度迅速减慢,几秒钟后反应几乎停止 |
无法持续产生气体,不能用于实验室制取 |
| C |
(2)根据实验探究,实验室制取
的化学反应原理为(用化学方程式表示)
[拓展迁移]
将上述实验C反应后的混合物过滤。对滤液中的溶质,小聪同学提出了以下三种猜想:
①溶质是
;②溶质是
;③溶质是
和
该小组成员一起讨论后认为,上述三种猜想中有一种是不合理的,你认为不合理的猜想是(填序号)。对小聪的另外两种合理猜想,请你设计实验,并根据不同现象说明溶液中的溶质属于哪一种猜想。
通过下列实验,回答问题:


甲 乙 丙
⑴甲实验的化学方程式是。
⑵乙实验是利用红磷的燃烧测定空气中氧气含量的实验,请写出红磷燃烧的化学方程式,待冷却后,打开止水夹,观察到的现象是 。
⑶丙实验,向盛有红棕色二氧化氮气体的平底烧瓶中放入几小块烘烤过的木炭,迅速塞上单孔橡皮塞,观察到的现象是,这体现了木炭具有性。
⑷方法感悟:甲实验是通过电解水后,验证生成物是氢气和氧气来得出水的组成,其依据是;乙实验是利用可燃物消耗瓶内的氧气而不生成气体,从而使瓶内气体压强减小来测定空气中氧气的含量;乙实验和丙实验中都消耗了瓶内的气体,其本质区别是.
下列知识归纳,不完全正确的一组是
| A. |
化学反应中的能量变化
①物质的缓慢氧化均放出热量 ②物质发生化学反应的同时伴随着能量变化 ③在化学反应中只有燃烧才能放出热量 |
| B. |
实验中的现象
①向浓氨水中加入无色酚酞,溶液变红 ②将铁钉放入硫酸铜溶液中,铁钉表面有红色物质析出,溶液颜色变浅 ③硫酸铜溶液和氢氧化钠溶液反应有蓝色絮状不溶物生成 |
| C. |
"低碳经济"的措施
①改造或淘汰高能耗、高污染产业 ②研制和开发新能源替代传统能源 ③近距离出行时,用自行车替代机动车 |
| D. | 影响化学反应速率的因素 |
①是否使用催化剂
②反应物的浓度
③反应物的接触面积
某化学兴趣活动小组的同学学习"灭火器原理"后,设计了如下图所示实验,并对反应后锥形瓶中残留废液进行探究。

【提出问题】
废液中所含溶质是什么物质?
【猜想与假设】
猜想(一):废液中的溶质可能是
、
和
。
猜想(二):废液中的溶质只有
。
猜想(三):废液中的溶质是
和
。
猜想(四):废液中的溶质是。
【讨论与交流】
小明认为猜想(一)无需验证就知道是错误的。他的理由是。
【实验与结论】
(1)为验证猜想(二),小强同学取少量废液装入试管中,然后滴入
溶液,产生白色沉淀,滴加稀硝酸沉淀不溶解。于是小强认为猜想(二)正确。小强的实验(填"能"或"不能")验证猜想(二)的正确性,原因是。
(2)小丽为验证猜想(三),选用大理石做试剂。若猜想(三)是正确的,验证时反应的化学方程式为。
(3)若验证猜想(四)是否正确,下列试剂中可选用的有(填序号)。
①氢氧化钠溶液 ②氯化钙溶液 ③稀盐酸 ④氯化钾溶液
【拓展与应用】
若废液中的溶质是
和
,根据
的性质,无需另加试剂,只要对废液进行操作即可从废液中得到
固体。此方法的缺点是。
下图是某同学设计的验证
化学性质的实验装置。请回答:

(1)该同学连接装置
的目的是。我认为:在此实验中(填"有"或"没有")必要连接此装置。
(2)利用上图装置进行实验,开始通入
气体时,在
处可观察到的现象是。
(3)装置
在初中化学中常用来检验
气体,是因为
能使澄清的石灰水;实验过程中,在
处可观察到紫色石蕊溶液。
某同学设计的"从含铜电缆废料中提取铜"的实验方案如下:

(1)过滤用到的玻璃仪器有、、。
(2)写出步骤③和步骤⑤发生反应的化学方程式:
步骤③:;
步骤⑤:。
(3)此方案中可能造成空气污染的步骤有。
通过学习氧气的性质,知道镁在氧气中燃烧会生成白色固体物质。但某学习小组的同学发现在空气中点燃镁条时,生成的白色固体物质中夹杂着少量的淡黄色固体。为了探究其原因,他们做了以下工作:
[提出问题] 淡黄色固体物质的成分是什么?
[查阅资料] 通过查阅资料,记录了下列几种物质的颜色:
| 物 质 |
MgO |
MgCl2 |
Mg3N2 |
Mg(NO3)2 |
MgCO3 |
Mg(OH)2 |
| 颜 色 |
白色 |
白色 |
淡黄色 |
白色 |
白色 |
白色 |
某同学推断产物中一定不存在氯化镁,你认为他的理由是 ; 0.5分
[提出猜想] 分析以上资料,同学们认为淡黄色的固体可能是镁与空气中的
(填写化学式)反应生成的;0.5分
[实验探究] 如果让你设计实验验证上述猜想,你的方案是 ;1分
[实验结论] 根据实验结果,写出镁条在空气中燃烧时发生反应的化学方程式:
、 ;1分
[反思与评价] 通过上述探究,你对燃烧的新认识是 。1分
“用双氧水和二氧化锰制氧气”的反应方程式为: 。1分
某同学做了该实验后,展开了下列思考与探究:
(1)催化剂MnO2的用量对反应速率有没有影响呢?
他做了这样一组实验:每次均用30mL10%的H202溶液,采用不同量MnO2粉末做催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其他实验条件均相同)
| 实验次序 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| MnO2粉末用量(克) |
0.1 |
0.2 |
0.3 |
0.4 |
0.5 |
0.6 |
0.7 |
0.8 |
0.9 |
1.0 |
| 所用时间(秒) |
17 |
8 |
7 |
5 |
4 |
3 |
2 |
2 |
2 |
2 |
请分析表中数据回答:MnO2的用量对反应速率有没有影响呢?如果有,是怎样影响的呢?
答: 。1分
(2)H2O2溶液的溶质质量分数对反应速率有没有影响呢?
他又做了一组实验:每次均取5mL30%的H2O2溶液,然后稀释成不同溶质质量分数的溶液进行实验。记录数据如下:(实验均在20℃室温下进行,其他实验条件也均相同)
| 实验次序 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
| H2O2溶液溶质质量分数 |
1% |
3% |
5% |
10% |
15% |
20% |
25% |
30% |
| MnO2粉末用量(克) |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
| 收集到540mL气体时所用时间(秒) |
660 |
220 |
205 |
80 |
25 |
9 |
4 |
3 |
| 反应后液体温度(℃) |
24 |
34 |
39 |
56 |
65 |
67 |
69 |
70 |
请分析表中数据回答:H2O2溶液的溶质质量分数对反应速率有没有影响呢?如果有,是怎样影响的呢?
答: 。1分
由表中数据还可看出,该反应是个 反应(填“放热”或“吸热”)。0.5分
(3)还有哪些因素可能影响该反应的速率呢?
请说出你的一个猜想: 。0.5分
某化学兴趣小组的同学将一枚洁净的铁钉放入食盐水中(如图,装置气密性良好),一段时间后,进行观察。请你一起参与分析,并完成后续实验设计。

[观察现象]①装置中右侧导管中的液面升高。
②铁钉生锈,试管底部有黑色固体物质。
[提出问题]导管中液体为何升高?黑色固体物质又是什么?
[理论分析]小组同学根据已学过的知识分析得知,液面上升的原因是。
[猜想与假设]小组中的小明同学猜测该黑色固体可能含有:①
、②
、③
、④
四种物质。
[分析与验证]小组同学根据小明的四种猜测做了以下分析:
⑴小红同学认为不可能含有氯化铁,该结论得到小组同学的认可,理由是。
⑵小强同学认为一定含有碳,该结论也得到小组同学的认可,理由是 。
⑶小组同学不能确定是否含有铁,请人帮他们设计方案进行确认:
| 实验步骤 |
实验现象 |
实验结论 |
| 你选用的试剂是: |
|
|
[知识链接]相信你一定在家中做过铁钉分别在水以及食盐水中生锈的实验,你的结论之一是铁钉在 (填"水"或"食盐水")中生锈快。
某化学兴趣小组同学欲除去固体氯化钠中混有的氯化钙。设计实验方案如下,请参与实验并回答问题。
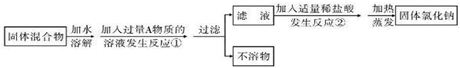
⑴写出A物质的化学式:,写出A物质的俗称:。
⑵写出反应②的化学方程式:。
⑶反应①中加入过量A物质的目的是;反应②中如果加入盐酸也过量,则对所得到的氯化钠纯度(填"有"或"没有")影响。
⑷分离后所得氯化钠的质量与分离前原混合物中氯化钠的质量相比较,结果 (填"增大"、"不变"或"减少")