某同学要探究燃烧的条件和空气中氧气的含量,进行了如下实验。
[实验一](已知:白磷的着火点为40℃)
实验装置 |
实验步骤及现象 |
|
步骤Ⅰ.检验装置的气密性,气密性良好。 步骤Ⅱ.将盛有白磷的带孔燃烧匙伸入A瓶中,白磷不燃烧。 步骤Ⅲ.向A瓶中加满80℃热水,塞紧瓶塞,白磷不燃烧。 步骤Ⅳ.打开K1、K2,从a口向瓶中鼓入空气,待瓶中的液面低于燃烧匙底部时,关闭K1、K2.此时进入量筒B中水的体积为200mL,观察到A瓶中的白磷燃烧。 |
(1)对比步骤Ⅱ和Ⅳ的现象可知,可燃物燃烧的条件之一是
(2)待装置冷却一段时间后,打开K2,如果观察到 ,说明空气中氧气的体积约占 .若实验测得空气中氧气的体积分数小于
.若实验测得空气中氧气的体积分数小于 ,原因可能是 (答一条即可)。
,原因可能是 (答一条即可)。
[实验二]用如图所示装置,利用铁生锈的原理也可以比较准确地测出空气中氧气的含量。若将此装置中的细铁丝换成足量的细铜丝进行实验,能否比较准确地测出空气中氧气的含量,并说明理由 。[已知:铜能与空气中氧气、水、二氧化碳反应生成铜绿。化学方程式:2Cu+O2+H2O+CO2═Cu2(OH)2CO3]

如图是用燃磷法测定空气中氧气体积分数的实验装置,请你回答下列有关问题:
(1)红磷燃烧时冒出浓厚的 ,反应的化学方程式是 .
(2)红磷燃烧消耗氧气,并且生成固体,使得集气瓶内的 减小,致使烧杯中的水倒吸入集气瓶,从而粗略测出空气中氧气的体积分数.
(3)燃烧结束后,当集气瓶 后松开弹簧夹,过一会儿观察到进入集气瓶中水的体积约占集气瓶总体积的五分之一.

以下是初中化学中常见的基本实验,回答下列问题。

(1)写出用A装置来制取气体的化学方程式 。
(2)B装置是用红磷燃烧测定空气中氧气含量的实验。写出红磷在空气中燃烧的化学反应方程式 _;待红磷熄灭且集气瓶冷却后,打开弹簧夹,烧杯中的水进入集气瓶中,水面大约上升至刻度 时不再上升。
(3)C装置是电解水的实验,指出试管1中收集的气体是 。
(4)D装置中看到的实验现象是 ,由此可以得出二氧化碳具有的性质是不能燃烧、 。
(5)河水经过E装置净化后得到的水是 (选填“纯净物”或“混合物”)。
小明同学设计以下实验来探究可燃物燃烧的条件和测定空气中氧气的含量.(已知:白磷的着火点是40℃,红磷的着火点是240℃)
| 实验装置 |
实验过程 |
实验现象 |
| |
①取一烧杯,加入适量的生石灰,再分别取少量白磷、红磷放在烧杯上的铜片上. ②… |
一会儿白磷发生燃烧,红磷不燃烧 |
| |
③先在容积为350mL的集气瓶中装进50mL滴有红墨水的水,在燃烧匙中放足量白磷,量筒中盛入足量水. ④按图连好仪器,用激光手电照射白磷,白磷燃烧. |
集气瓶和量筒中的水均为红色,量筒内的液体体积减少约60mL |
(1)实验过程②是 ,烧杯中发生反应的化学方程式为 ;
(2)白磷燃烧反应的化学方程式为 ;
(3)根据实验2的结果,计算空气中氧气的体积分数约为 (写出计算式和结果);
(4)在整个实验2的过程中,集气瓶内的压强变化是 ,集气瓶中预先装入50mL水,水起的作用是 .
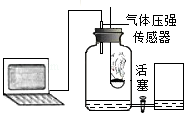
某科学兴趣小组对"测定空气中氧气含量"的实验进行了改进:将数显设备、气体压强传感器和空气中氧气含量测量装置按如图连接。装置气密性良好,调节右边敞口容器和集气瓶里的水面相平,此时集气瓶内气体的体积为V 1.关闭活塞,点燃燃烧匙内的红磷,立即塞紧瓶塞,待火焰熄灭后,过一段时间打开活塞,观察到集气瓶中的水位上升。待集气瓶内的水面不再上升时,集气瓶内的气体体积为V 2. 然后向右边容器内加入一定量的水至两边水面再次相平,此时集气瓶内的气体体积为V 3.在点燃红磷至打开活塞这一过程中,观察到数显设备显示集气瓶内的气体压强先上升后下降,再趋于稳定。
请回答:
(1)数显设备显示,开始一段时间集气瓶内气体压强上升,这是因为温度升高导致的气压变化量 (选填"大于"、"等于"或"小于")氧气量减少导致的气压变化量。
(2)基于数显设备显示的气压变化,"过一段时间打开活塞"中的"一段时间"指的是火焰熄灭后到 所经历的时间。
(3)在整个实验过程中,集气瓶中减少的氧气体积为 (选填"V 1﹣V 2"、"V 1﹣V 3"或"V 2﹣V 3")。
空气中氧气含量测定的经典赏析。
教材中介绍了拉瓦锡用定量的方法研究了空气的成分(实验装置如图)。

(1)写出汞与氧气反应的化学方程式 。
(2)本实验中选择使用汞的优点有:
①汞在加热的条件下,只和氧气反应。②汞为液态,在汞槽中起到液封的作用,并能直接用来测见反应器内空间体积的变化。
③生成的氧化汞分解又能得到汞和氧气,把得到的氧气加到剩下的 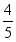 体积的气体中,结果所得气体跟空气的性质完全一样。
体积的气体中,结果所得气体跟空气的性质完全一样。
根据资料卡片,请再补充本实验使用汞的两个优点,并说明依据。
④ 。 ⑤ 。
(3)通过实验,拉瓦锡得出了空气由氧气和氮气组成,其中氧气约占空气总体积 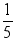 的结论。请根据现在的认识,对此结论予以补充。 。
的结论。请根据现在的认识,对此结论予以补充。 。
空气中氧气含量测定的再认识。
【经典赏析】教材中介绍了拉瓦锡用定量的方法研究了空气的成分(实验装置如图1)。该实验中选择使用汞的优点有 。
A.实验过程中没有污染
B.在汞槽中起到液封作用
C.生成的化合物加热分解又能得到汞和氧气
D.能将密闭装置内空气中的氧气几乎耗尽
【实验回顾】实验室常用红磷燃烧的方法测定空气中氧气的含量(装置如图2),写出红磷燃烧的化学方程式 。兴趣小组用该方法测出的氧气含量常常远低于21%。
【提出问题】用红磷燃烧的方法为什么不能准确地测定空气中氧气的含量?
【进行猜想】(1)装置漏气;(2) 装置内氧气有剩余;…
【实验与交流】在老师的指导下,小明分别用过量的红磷和白磷进行该实验,用测氧气浓度的传感器测得反应后装置内氧气浓度分别为8.85%和3.21%,请从燃烧条件的角度回答产生上述结果的主要原因 。
【实验探究1】小明根据铁生锈的原理,探究用铁能否准确测定空气中氧气的含量,于是进行了实验(装置如图3)通过7天测得的数据计算空气中氧气的含量为19.13%。
【交流与反思】与用红磷燃烧的方法相比,用铁丝生锈的方法测定的主要优点及原因: 。
【实验探究2】为了加快反应速率,小明通过查阅资料,利用铁粉、炭粉、氯化钠等物质又进行了实验(装置如图4),8分钟后测得的数据如表:
| 实验前的体积 |
实验后的体积 |
|
| 集气瓶内空气 |
烧杯内蒸馏水 |
烧杯内剩余蒸馏水 |
| 131mL |
90.0mL |
63.6mL |
请计算出空气中氧气含量 (计算结果保留一位小数)
【结论与反思】通过上述实验探究,选择 (填物质名称)进行实验,可较为快速地完成实验并减小实验误差。
【拓展延伸】铜也能与空气中氧气、水、二氧化碳反应而锈蚀,生成铜绿[铜绿的主要成分为Cu 2(OH) 2CO 3],若将图3装置中的粗铁丝换成足量的铜丝进行实验,请判断能否比较准确地测定空气中氧气的含量,并说明理由。 。

化学是以实验为基础的学科,根据实验一、实验二回答下列问题:
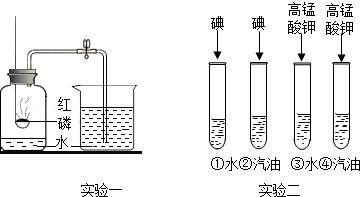
(1)实验一:待红磷熄灭冷却后,打开弹簧夹,观察到集气瓶内水面上升约 ,该现象说明氮气具有的性质是 .
(2)实验二:试管③的现象为 ;将试管②和④的现象相比较得到的结论是 .