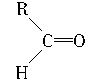
 +R′CH2COOC2H5
+R′CH2COOC2H5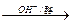
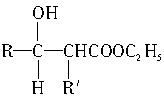
聚乙烯醇肉桂酸酯是最早用于光刻胶的光敏高分子化合物,其合成途径如下:
合成步骤一: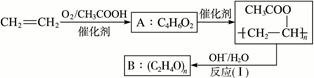
合成步骤二: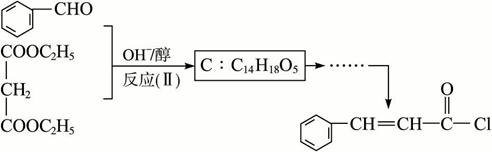
合成步骤三: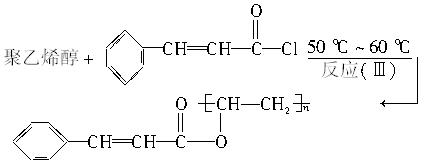
(聚乙烯醇肉桂酸酯)
(1)写出A的结构简式:_________________。
(2)写出反应(Ⅰ)的化学方程式__________________________________。
(3)反应(Ⅱ)的类型是_________________,反应(Ⅲ)的类型是_________________。
(4)C4H6O2同分异构体甚多,其中属于羧酸的同分异构体的为:_______________________、_____________________、___________________、_______________________。
有机物R的相对分子质量为122,在空气中燃烧只生成CO2和H2O。
(1)若R为烃,则其分子中可能含有_________________ (填标号,多选倒扣分)。
| A.两个C≡C键 | B.一个C==C键和一个C≡C键 |
| C.一个环状结构和一个C==C键 | D.一个环状结构和一个C≡C键 |
E.一个苯环
(2)若R为芳香醇,则R的同分异构体甚多,其中与R不同类别且分子中只含有一个甲基的同分异构体有五种,现已知下列三种,请写出另外两种的结构简式: 、
、 、
、
_________________、_________________。
已知A为饱和一元羧酸,B是饱和一元羧酸和饱和一元醇生成的酯。现有A、B、组成的混合物1.5 mol,其质量为90 g,与足量的金属钠反应后放出氢气11.2 L(标准状况)。求混合物中A是什么酸?B可能是什么酯?写出它们的结构简式。
某有机化合物A的结构式如下:
(1)A的分子式是_________________。
(2)A在NaOH水溶液中加热反应得B和C,C是芳香化合物。B和C的结构简式是B_________________,C_________________。该反应属于_________________反应。
(3)室温下,C用稀盐酸酸化得到E,E的结构简式是_________________。
(4)在下列物质中,不能与E发生化学反应的是(填写序号)_________________。
①浓H2SO4和浓HNO3的混合液②CH3CH2OH(酸催化)③CH3CH2CH2CH3④Na
⑤CH3COOH(酸催化)
(5)写出同时符合下列两项要求的E的所有同分异构体的结构简式。
①化合物是1,3,5三取代苯
②苯环的三个取代基分别为甲基、羟基和含有 结构的基团。
结构的基团。
(12分)通常羟基与烯键碳原子相连时,易发生下列变化:
现有如下图所示的转化关系:
已知E遇氯化铁溶液显紫色,F转化为G时,产物只有一种结构,且能使溴水褪色,试完成下面问题:
(1)写出下列物质的结构简式:A___________;B___________;G___________。
(2)F转化为G的反应类型:___________;化学方程式为______________________。
(3)C转化为D的化学方程式为___________。
(11分)有机物A是烃的含氧衍生物。在同温同压下,A蒸气的质量是同体积乙醇蒸气的2倍。1.38 g的A完全燃烧后,将燃烧产物通过碱石灰,碱石灰增重3.06 g;若将燃烧产物通过浓H2SO4,浓H2SO4增重1.08 g。取4.6 g A与足量钠反应,生成气体在标准状况下的体积为1.68 L。已知A不与NaOH反应,试确定A的结构简式和名称。
(8分)已知:
①CH3COONa+NaOH CH4↑+Na2CO3
CH4↑+Na2CO3
②R—CH==CH2+H2O RCH2CH2OH
RCH2CH2OH
现有分子式为C8H9Br的有机物在一定条件下能发生下图所示的一系列反应:
请完成下列问题:
(1)写出C8H9Br的结构简式:__________。
(2)上述反应中属于取代反应的有(填编号) __________,反应③④⑦⑩各属何种类型反应__________________________________________________。
(3)写出③⑥⑨三个反应的化学方程式:
③____________________________________________________________;
⑥____________________________________________________________;
⑨____________________________________________________________。
(4)写出B可能有的3种同分异构体(要求:①苯环上只有一个取代基,②3种异构体不同类别):
______________________________________________________________________________。
(9分)有机物A的结构简式为:
从A出发,可以发生下列所示的一系列反应,其中K的分子式为C12H14O4,L和K互为同分异构体,F的产量可作为衡量一个国家石油发展水平的标志。
请完成下列问题:
(1)FH的反应类型是_________。
(2)下列物质的结构简式:
B:_________;K:_________;L:_________。
(3)写出与B互为同分异构体,且苯环上只有一个取代基的各有机物的结构简式。

(7分)2005年11月13日,吉林石化公司双苯厂发生的爆炸事件,使大量的苯胺及其生产原料(苯、硝基苯等)进入松花江,造成松花江水体被严重污染。
(1)下列有关叙述正确的是__________ (填序号)。
A.进入水体的苯会溶于水,造成鱼类大量中毒死亡
B.进入水体的硝基苯会浮在水面上迅速流向下游
C.工业上用硝基苯制取苯胺是氧化反应:
D.苯和硝基苯的混合物可通过蒸馏的方法将其分离
(2)自来水厂对上述受污染的江水进行净化处理,采取的经济有效的方法是________(填序号)。
A.分液 B.过滤C.用活性炭吸附有毒物质 D.加热蒸发
(3)磺胺类药物,常用于肠道抗菌感染的治疗。工业上可用苯为原料通过下列反应制得磺胺。(转化关系中—H2O、—HCl、—CH2COOH分别表示反应中有H2O、HCl、CH3COOH生成)



①反应Ⅰ的反应类型是_________反应。
②分析上述反应过程中所提供的有关信息,写出C的结构简式:__________________。
③写出D E的化学方程式:____________________________________。
E的化学方程式:____________________________________。
卤代烃分子中的卤素原子与活泼金属阳离子结合,发生下列反应:
R—X+2Na+X-R′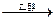 R-R′+2NaX
R-R′+2NaX
R—X+NaCN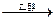 R—CN+NaX
R—CN+NaX
根据下列物质的转化关系如下图所示回答下列问题: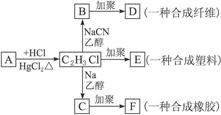
(1)A的结构简式是_________________,E的结构简式是_________________。
(2)B D的化学方程式是___________________________________________________。
D的化学方程式是___________________________________________________。
(3)C F的化学方程式是___________________________________________________。
F的化学方程式是___________________________________________________。
(1)为防治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用。请写出燃烧时,有关“固硫”(不使含硫化合物进入大气)反应的化学方程式_______________________________。
(2)某有色金属冶炼厂排放的废气中含SO2,先用石灰浆吸收SO2,然后利用空气中的氧气将产物继续氧化成石膏(CaSO4·2H2O)。写出两个反应的化学方程式
_______________________________。
已知25 ℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制醋酸的电离,使c(H+)减小,因此溶液的pH增大。你认为上述两种解释中_________(“甲”或“乙”)正确。
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1 mol·L-1的醋酸溶液中加入少量下列物质_________(填写编号),然后测定溶液的pH。
| A.固体CH3COOK |
| B.固体CH3COONH4 |
| C.气体NH3 |
| D.固体NaHCO3 |
(2)若_________(填“甲”或“乙”)的解释正确,溶液的pH应_________(填“增大”“减小”或“不变”)。(提示:25 ℃时,测得CH3COONH4溶液的pH≈7)
下图表示A~E五种物质的相互转化关系,其中A为淡黄色固体,B为单质。
(1)试推断A、B、C、D、E的化学式:
A.________,B. ________,C. ________,
D. ________,E. ________。
(2)写出标号①②③⑧的化学反应方程式:
①________________________________,
②________________________________,
③________________________________,
⑧________________________________。
(经典回放)下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
(1)下列________________(填写编号)组元素的单质可能都是电的良导体。
①a、c、h②b、g、k③c、h、l④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
①原子核对核外电子的吸引力
②形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1)
| 锂 |
X |
Y |
|
| 失去第一个电子 |
519 |
502 |
580 |
| 失去第二个电子 |
7 296 |
4 570 |
1 820 |
| 失去第三个电子 |
11 799 |
6 920 |
2 750 |
| 失去第四个电子 |
9 550 |
11 600 |
通过上述信息和表中的数据分析锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量的原因。
____________________________________________________。
②表中X可能为以上13种元素中的(填写字母)元素。用元素符号表示X和j形成化合物的化学式____________________________________________________。
③Y是周期表中____________族元素。
④以上13种元素中____________(填写字母)元素原子失去核外第一个电子需要的能量最多。