有A、B、C、D四种无色溶液,它们分别是Na2CO3、Na2SO4、H2SO4、BaCl2中的某一种,为确定各是何种溶液,进行以下实验:(1)A+B→溶液+气体;(2)C+D→溶液+沉淀;(3)B+D→溶液+沉淀(X);(4)A+D→溶液(Y)+沉淀;(5)沉淀(X)+溶液(Y)→溶液+气体。
由以上实验可知A为________,B为________,C为________,D为________。
请写出有关的化学方程式:
(1)___________________________
(2)_________________________ (3)________________________
(4)_________________________ (5)________________________
0.5 mol X元素的离子被还原成中性原子时,需要得到6.02×1023个电子;0.4 g X的单质与盐酸充分反应放出0.02 g氢气;Y元素的阴离子结构与氩原子结构相同,它的气态氢化物水溶液是强酸。
(1)推断X、Y两种元素的名称及在周期表中的位置。
(2)用电子式表示X、Y形成化合物的过程。
下列两个反应的反应原理是否存在矛盾?为什么?
①Na2SiO3+CO2+H2O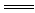 H2SiO3↓+Na2CO3
H2SiO3↓+Na2CO3
②siO2+Na2CO3 Na2SiO3+CO2↑
Na2SiO3+CO2↑
今有H2、Cl2混合气100mL(标况),其中一种气体体积为45mL。光照使两种气体发生反应后恢复到标况,气体体积为______mL。为了说明反应后气体中H2或Cl2有剩余,使气体通过10mL水,并使剩余气体干燥后恢复到标况,若(1)剩余________mL,证明有________剩余;理由___________________。(2)溶液有________性质,证明有________剩余;理由是____________________________。
(16分)聚乙烯醇是生产合成纤维——维纶、黏合剂——胶水、涂料、婴儿尿不湿布料的一种重要化工原料。聚乙烯醇因具有水溶性,不释放有机溶剂污染环境而备受人们的喜爱。下面是生产聚乙烯醇的一种反应原理。
羧酸酯RCOOR′在催化剂存在时可跟R″OH醇发生如下反应(R′,R″是两种不同的烃基):RCOOR′+R″OH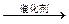 RCOOR″+R′OH,此反应称为酯交换反应,常用于有机合成中,在合成维纶的过程中,有一个步骤是把聚乙酸乙烯酯
RCOOR″+R′OH,此反应称为酯交换反应,常用于有机合成中,在合成维纶的过程中,有一个步骤是把聚乙酸乙烯酯 转化成聚乙烯醇,这一步就是用过量的甲醇进行酯交换反应来实现的。
转化成聚乙烯醇,这一步就是用过量的甲醇进行酯交换反应来实现的。
请完成下列问题:
(1)反应中甲醇为什么要过量?__________________________________________________。
(2)写出聚乙烯醇的结构简式:____________________________________________________。
(3)写出聚乙酸乙烯酯与甲醇进行酯交换反应的化学方程式:__________________________。
与水解反应类似,在一定条件下,酯也能发生氨解反应。请写出下列反应方程式,并指出反应类型。
(4)聚乙酸乙烯酯的水解:_________________,______________________________________。
(5)聚乙酸乙烯酯的氨解:_________________,______________________________________。
(9分)酯和醇反应生成新的酯和新的醇的反应称为酯交换反应: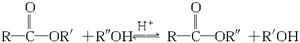
工业上生产“的确良”是以甲醇、乙二醇和对苯二甲酸(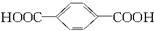 )为原料生产的。具体合成途径如下:
)为原料生产的。具体合成途径如下:
含少量杂质的对苯二甲酸用 对苯二甲酸二甲酯
对苯二甲酸二甲酯 “的确良”
“的确良”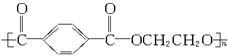 。
。
完成下列填空:
(1)反应(Ⅰ)的化学方程式为
_______________________________________________________。
(2)反应(Ⅱ)的类型是____________________________________________(填“加聚”或“缩聚”)。
(3)反应(Ⅱ)中要及时蒸出甲醇是因为
_______________________________________________。
据报道,人从食物中摄取碘后,碘在甲状腺中积存下来通过一系列化学反应可形成甲状腺素。甲状腺素的结构如下:
(1)甲状腺素的分子式为________________。
(2)在甲状腺内,甲状腺素的合成过程可能是: 二碘酪氨酸
二碘酪氨酸 甲状腺素和丙氨酸
甲状腺素和丙氨酸
试完成下列问题:
①上述两步反应类型分别是_____________反应、_____________反应。
②试写出上述两步化学反应的方程式。
(3)人体分泌甲状腺激素过少,婴儿时将患_____________,成人时将引起_____________。
(8分)我国规定饮用水质量标准必须符合下列要求:pH为6.5—8.5,Ca2+和Mg2+总浓度小于0.004 5 mol·L-1,细菌总数小于100个每毫升。下图是源水处理成自来水的工艺流程示意图。

(1)源水中含Ca2+、Mg2+、 、Cl-等,加入石灰后,生成Ca(OH)2,进而发生多个复分解反应,请写出其中三个反应的离子方程式:①__________________;②__________________;③_________________________________。
、Cl-等,加入石灰后,生成Ca(OH)2,进而发生多个复分解反应,请写出其中三个反应的离子方程式:①__________________;②__________________;③_________________________________。
(2)凝聚剂除去悬浮固体颗粒的过程是______________________ (填序号)。
A.只是物理过程 B.只是化学过程 C.是物理和化学过程
(3)绿矾在水中最终生成______________________沉淀。
(4分)液化石油气已进入城镇居民家中。
(1)有时由于一些原因会出现液化石油气大量外喷的情况。外喷的液化石油气溅洒在皮肤上可能会发生皮肤冻伤事故,请解释原因。
(2)若液化石油气不慎泄漏起火,干粉是极有效的灭火剂。着火时,用手抓一把干粉灭火剂朝火焰方向抛洒,它遇火燃烧后迅速产生大量的二氧化碳,起到隔绝空气的作用。问该灭火剂的主要成分可能是____________。
| A.NaHCO3 | B.CaCO3 | C.Na2CO3 | D.NH4HCO3 |
(10分)“西气东输”是西部开发的重点工程,这里的气是指天然气。工业上将碳与水在高温下反应制得水煤气,其中CO和H2的体积比为1∶1。
已知1 mol CO气体完全燃烧生成CO2气体放出283 kJ热量;1 mol氢气完全燃烧生成液态水放出286 kJ热量;1 mol CH4气体完全燃烧生成CO2气体和液态水放出890 kJ热量。
(1)写出氢气完全燃烧生成液态水的热化学反应方程式:
________________________________________________________________________________
1 mol CH4气体完全燃烧生成CO2气体和水蒸气,放出的热量__________890 kJ(填“>”、“=”或“<”)。
(2)若忽略水煤气中的其他成分,在相同状况下要得到相等的热量,则所需水煤气与甲烷的体积比为__________;两者燃烧生成的CO2的质量之比为__________(前者比后者)。
(3)以上数据和计算说明,以天然气代替水煤气作民用燃料,突出的优点是_______________
_______________________________________________________________________________。
(1)A、B、C三种物质的分子式都是C7H8O。若滴入FeCl3溶液,只有C呈紫色;若投入金属钠,只有B无变化。
①写出A、B的结构简式:A_________,B_________。
②C有多种同分异构体,若其一溴代物最多有两种,C的这种同分异构体的结构简式是__________________。
(2)有7瓶有机物A、B、C、D、E、F、G,它们可能是苯、甲苯、己烯、苯酚、乙醇、乙酫、乙酸,为确定每瓶成分,进行下列实验:
①取7种少量有机物,分别加水,振荡后与水分层的是A、D、G;
②取少量A、D、G分别加入溴水,振荡后,只有D不仅能使溴水褪色,而且油层也无色;
③取少量A、G,分别加入酸性KMnO4溶液,振荡后,G能使酸性KMnO4溶液褪色;
④取A少量,加入浓H2SO4和浓HNO3,加热后倒入水中,有苦杏仁味黄色油状液体生成;
⑤取少量B、C、E、F,分别加入银氨溶液,经水浴加热后,只有B出现银镜;
⑥取少量C、E、F,若分别加入金属钠,均有H2放出;若分别加入Na2CO3溶液,只有F有气体放出;
⑦取少量C、E,滴入FeCl3溶液,E溶液呈紫色;
⑧取少量C、F,混合后加入浓H2SO4,加热后有果香味的油状液体生成。
试推断A—G各是什么物质?A_________,B_________,C_________,D_________,E_________,F_________,G_________。
已知: (注:R、R′为烃基)
(注:R、R′为烃基)
A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品。A能发生如下图所示的变化。
试完成下列问题:
(1)写出符合下述条件A的同分异构体结构简式(各任写一种):
a.具有酸性__________________,b.能发生水解反应__________________。
(2)A分子中的官能团是__________________,D的结构简式是__________________。
(3)C→D的反应类型是__________________,E→F的反应类型是__________________。
a.氧化反应 b.还原反应 c.加成反应 d.取代反应
(4)写出化学方程式:A→B________________________________。
(5)写出E生成高聚物的化学方程式:________________________________________。
(6)C的同分异构体C1与C有相同官能团,两分子C1脱去两分子水形成含有六元环的C2,写出C2的结构简式:________________________________。
苏丹红一号(sudan Ⅰ)是一种偶氮染料,不能作为食品添加剂使用。它是由苯胺和2萘酚为主要原料制备的,它们的结构简式如下所示: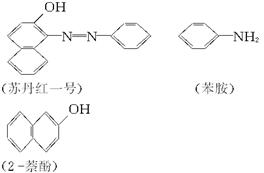
(1)苏丹红一号的化学式(分子式)为____________________。
(2)在下面化合物(A)—(D)中,与2萘酚互为同分异构体的有(填字母代号)________________。(提示: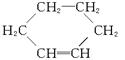 可表示为
可表示为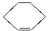 )
)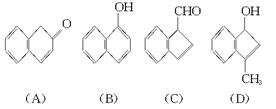
(3)上述化合物(C)含有的官能团是___________________________。
(4)在适当的条件下,2萘酚经反应可得到芳香化合物E(C8H6O4),1 mol E与适量的碳酸氢钠溶液反应可放出二氧化碳44.8 L(标准状况),E与溴在有催化剂存在时反应只能生成两种一溴取代物,两种一溴取代物的结构简式分别是___________________________,E与碳酸氢钠反应的化学方程式是_________________________________________。
(5)若将E与足量乙醇在浓硫酸作用下加热,可以生成一个化学式(分子式)为C12H14O4的新化合物,该反应的化学方程式是_________________________________________,反应类型是_______________________。