请回答下列问题:
(1)下列属于无机非金属材料的是
A.高强度水泥 B.钢化玻璃
C.氧化铝陶瓷 D.光导纤维
(2)磷酸钙陶瓷也是一种新型无机非金属材料,它可以用于制成人造骨骼,这是利用这类材料的
A.耐高温特性 B.电学特性
C.光学特性 D.生物功能
矿泉水一般是由岩石风化后被地下水溶解其中可溶部分生成的。此处所指的风化作用是指矿物与水和CO2同时作用的过程。例如钾长石(KAlSi3O8)风化生成高岭〔Al2Si2O5(OH)4〕,此反应的离子方程式为:2KAlSi3O8+2H2CO3+9H2O=2K++2HCO3-+4H4SiO4+Al2Si2O5(OH)4
这个反应能够发生的原因是______________。
(5分)A和B是同一主族的元素。A的最高正价与它的负价绝对值相等,可生成气态氢化物,其中氢的质量分数为25%;B跟氧形成的二氧化物是一种难溶于水的固体,其中氧的质量分数为53.3%,试推断A和B是什么元素,及它们在元素周期表中的位置。
X、Y、Z是中学化学中三种常见元素的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如下图关系:
试根据该图推断X、Y、Z的化学式(答案不止一组,请尽可能多地寻找合理解答)。
化学上将SCN-、OCN-、CN-等离子称为“类卤离子”。现将KSCN溶液滴加到酸性Fe3+溶液中,溶液立即变成红色。将此红色溶液分成两份:一份中加入KMnO4溶液,红色褪去;(1)向另一份中通入SO2时,红色也消失;(2)再滴加少量KMnO4溶液,其紫色也褪去。(3)试用离子方程式解释以上三部分颜色变化的原因(方程式可以不配平)。
A、B、C、D、E五种元素,它们的原子序数由A至E逐渐增大。D 的氢化物的分子式为H2D;D的最高价氧化物中D的质量分数为40%,且D原子的原子核中质子数和中子数相等。A原子最外电子层有4个电子。B的阴离子与C的阳离子和氖原子的电子层结构相同。E原子的M电子层上共有7个电子。常温常压下,B单质是气体,已知0.1 mol的B 单质与H2完全反应需2.408×1023个氢原子。C单质在加热条件下与B单质反应生成淡黄色固体。根据上述情况,试完成下列各问题:
(1)A—E的元素符号为___________、___________、___________、___________、___________。
(2)C位于元素周期表中第___________周期、第___________族,其阳离子的结构示意图为___________。
(3)D原子的电子式为___________;E离子的符号为___________。
(4)A元素与其余4种元素形成化合物的化学式为(仅限于由2种元素组成) ___________、___________、___________、___________。
(5)C单质和B单质在加热条件下生成A2B2反应的化学方程式为______________________;
反应中___________为氧化剂,___________为还原剂。
(6)1.15 g的C单质溶于50 mL水中,所得溶液中溶质的质量分数为___________。
在1—18号元素中,根据元素原子结构的特殊性填写下表:
| 原子核内无中子的原子 |
|
| 最外层只有1个电子的原子 |
|
| 最外层只有2个电子的原子 |
|
| 最外层电子数等于次外层电子数的原子 |
|
| 最外层电子数是次外层电子数2倍的原子 |
|
| 最外层电子数是次外层电子数3倍的原子 |
|
| 最外层电子数是次外层电子数4倍的原子 |
|
| 电子层数与最外层电子数相等的原子 |
|
| 电子层数为最外层电子数2倍的原子 |
|
| 次外层电子数是最外层电子数2倍的原子 |
|
| 内层电子总数是最外层电子数2倍的原子 |
有A、B、C三种元素,已知5.75 g A单质跟盐酸完全反应,在标准状况下,可产生2.8 L(标准状况下)H2和0.25 mol ACln;B的气态氢化物的分子式是H2B,其相对分子质量与B的最高价氧化物的水化物相对分子质量比为1∶2.88,B核内质子数与中子数相等;C和B可形成CB2液态化合物,并能溶解B的单质,试完成下列问题:
(1)A、B、C的名称;A离子的结构示意图;B在周期表中的位置;CB2的分子式。
(2)用电子式表示A与B形成化合物的过程。
下图表示A~E五种物质间的相互转化关系,其中A为淡黄色固体,B为单质。试推出各物质的化学式,并写出B→C、C→D、D→E反应的化学方程式。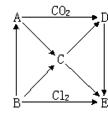
在50 mL b mol·L-1 AlCl3溶液中加入50 mL a mol·L-1的NaOH溶液。试问:
(1)当a≤3b时生成Al(OH)3沉淀的物质的量是_______________.
(2)当a、b满足什么条件时,无沉淀生成?
(3)当a、b满足什么条件时,先有沉淀生成后沉淀部分溶解?
重庆开县的天然气矿“井喷”事故对人畜造成了极大的伤害。主要原因是喷发出的天然气中含有浓度较大的硫化氢气体,这种气体具有臭鸡蛋气味,有剧毒,其毒性原理为阻断机体细胞的内呼吸导致全身缺氧。由于中枢系统对缺氧敏感,因而首先受到损害。其爆炸极限为4.3%~45.5%,着火点为292℃。其相对分子质量为34,与空气的相对密度为1.2。
针对这次“井喷”事故,有专家提出如下现场处理措施:
(一)在井架入口、井架上、钻台边上、循环系统等处设置风向标,一旦发生紧急情况,作业人员可向1方向疏散。
(二)在含硫钻井地区的生产班当班人员每人配一套空气呼吸器2,另配一定数量的公用呼吸器,并做到人人会用、会维护、会检查。
(三)加强对钻井液中硫化氢浓度的测量,充分发挥除硫剂和除气器的功能,保持钻井液中硫化氢含量在15mg﹒m-3以下。当硫化氢含量超过20mg﹒m-3安全临界浓度3时,工作人员应佩戴空气呼吸器,不允许单独行动,派专人监护现场。
(四)钻井队在现场条件下不能实施井控作业,决定放喷时,放出天然气烧掉4。
放喷点火应派专人进行……
(1)如果你负责疏散群众,那么,受灾人员的疏散方向时
A.顺风向 B.逆风向 C.地势高的方向 D.地势低的方向
(2)空气呼吸器中可盛放的物质是
A.氢氧化钠 B.碱石灰 C.氯化钠 D.氨水
(3)检测人员从现场取出500mL,含H2S 0.01mol,则此时工作人员
A.可安全生产 B.必须佩戴空气呼吸器
C.迅速离开现场 D.无法确定
(4)①点燃天然气时应注意什么问题?
②点燃天然气实属无奈之举,因为此法并不能完全消除环境污染,为什么?
据报道,1952年2月,某城市雾大无风,家庭和工厂排出的烟雾经久不散。大气中SO2的含量高达3.8 mg·m-3,烟尘达4.5 mg·m-3,居民健康普遍受到危害,4天之内死亡人数约4000人。回答:
(1)流经该城市的主要河道也因此而受到污染,引起鱼类死亡。这与此种类型大气污染形成__________有关。
(2)这种大气污染对人体__________系统的危害最大。将会造成__________等病症(举2种主要病症)。
(3)大气中的SO2将直接危害陆生高等植物的__________组织。
(4)为了防止这种污染,硫酸厂可用氨水吸收SO2。其离子方程式为。
(5)目前一种比较有效的方法是:用直升飞机喷撒白垩粉(CaCO3)以降解其污染,其化学方程式为。
甘蔗糖厂在生产过程中需要使用SO2气体,为此,需要在燃烧炉中燃烧硫磺(沸点为445℃)。在生产中发现如下情况:当液态硫表面上方3 mm左右空间的温度为360℃~380℃时,燃烧硫磺的火焰呈蓝色;当温度超过450℃,火焰呈白色,此时硫磺消耗的速度加快,但SO2产率明显降低,在输送SO2的管道中也随之出现较严重的堵塞。试解释其原因。
酸雨主要是大量燃烧含硫燃料释放出SO2所造成的,试回答下列问题:
(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
| 测试时间/h |
0 |
1 |
2 |
3 |
4 |
| 雨水的pH |
4.73 |
4.62 |
4.56 |
4.55 |
4.55 |
分析数据,回答下列问题:
①雨水样品的pH变化的原因是(用化学方程式表示)_______________。
②如果将刚取样的上述雨水和自来水相混合,pH将变______,原因是(用化学方程式表示)___________________。
(2)你认为减少酸雨产生的途径可采用的措施是______________。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
| A.①②③ | B.②③④⑤ |
| C.①③⑤ | D.①③④⑤ |
(3)有人在英国进行的一项研究结果表明:高烟囱可以有效地降低地表面SO2浓度.在20世纪的60~70年代的10年间,由发电厂排放出的SO2增加了35%,但由于建筑高烟囱的结果,地面浓度降低了30%之多.请你从全球环境保护的角度,分析这种方法是否可取?简述其理由.