空气中 含量的控制和 资源利用具有重要意义。
(1)燃煤烟气中 的捕集可通过如图所示的物质转化实现。

“吸收”后所得的 溶液与石灰乳反应的化学方程式为__________;载人航天器内,常用 固体而很少用 固体吸收空气中的 ,其原因是__________。
(2)合成尿素 是利用 的途径之一。尿素合成主要通过下列反应实现
反应Ⅰ:
反应Ⅱ:
①密闭体系中反应Ⅰ的平衡常数( )与温度的关系如图甲所示,反应Ⅰ的 _____(填“ ”或“ ”或“ ”)。
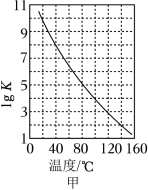
②反应体系中除发生反应Ⅰ、反应Ⅱ外,还发生尿素水解、尿素缩合生成缩二脲[ ]和尿素转化为氰酸铵( )等副反应。尿素生产中实际投入 和 的物质的量之比为 ,其实际投料比值远大于理论值的原因是_______________。
(3)催化电解吸收 的 溶液可将 转化为有机物。在相同条件下,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率( )随电解电压的变化如图乙所示。
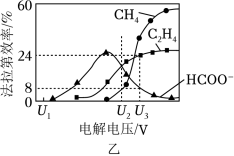
其中, , 表示电解生成还原产物 所转移电子的物质的量, 表示法拉第常数。
①当电解电压为 时,电解过程中含碳还原产物的 为 ,阴极主要还原产物为_____(填化学式)。
②当电解电压为 时,阴极由 生成 的电极反应式为__________。
③当电解电压为 时,电解生成的 和 的物质的量之比为_____(写出计算过程)。
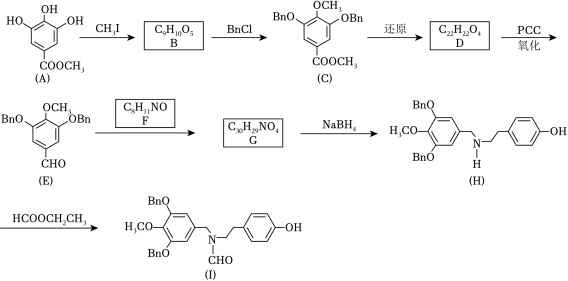
加兰他敏是一种天然生物碱,可作为阿尔茨海默症的药物,其中间体的合成路线如图。
已知:①
为
② (
为烃基,
为烃基或
)
(
为烃基,
为烃基或
)
回答下列问题:
(1)A中与卤代烃成醚活性高的羟基位于酯基的_____位(填“间”或“对”)。
(2)C发生酸性水解,新产生的官能团为羟基和_____(填名称)。
(3)用 代替 完成D→E的转化,化学方程式为_____。
(4)F的同分异构体中,红外光谱显示有酚羟基、无 键的共有_____种。
(5)H→I的反应类型为_____。
(6)某药物中间体的合成路线如图(部分反应条件已略去),其中M和N的结构简式分别为_____和_____。
硫酸工业在国民经济中占有重要地位。
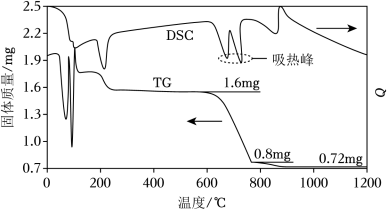
(1)我国古籍记载了硫酸的制备方法——“炼石胆( )取精华法”。借助现代仪器分析,该制备过程中 分解的TG曲线(热重)及 曲线(反映体系热量变化情况,数值已省略)如图所示。 左右有两个吸热峰,则此时分解生成的氧化物有 、_____和_____(填化学式)。
(2)铅室法使用了大容积铅室制备硫酸( 以下),副产物为亚硝基硫酸,主要反应如下:
ㅤ
(i)上述过程中 的作用为_____。
(ii)为了适应化工生产的需求,铅室法最终被接触法所代替,其主要原因是__________(答出两点即可)。
(3)接触法制硫酸的关键反应为 的催化氧化:
(i)为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率( )下反应速率(数值已略去)与温度的关系如图所示,下列说法正确的是_____。
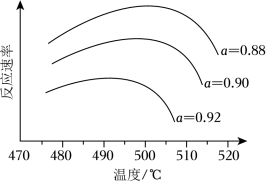
| A. |
温度越高,反应速率越大 |
| B. |
的曲线代表平衡转化率 |
| C. |
越大,反应速率最大值对应温度越低 |
| D. |
可根据不同 下的最大速率,选择最佳生产温度 |
(ii)为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如图所示,催化性能最佳的是_____(填标号)。
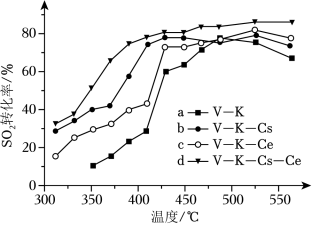
(iii)设 的平衡分压为 , 的平衡转化率为 ,用含 和 的代数式表示上述催化氧化反应的 _____(用平衡分压代替平衡浓度计算)。
我国科学家发现一种钒配合物Ⅰ可以充当固氮反应的催化剂,反应过程中经历的中间体包括Ⅱ和Ⅲ。
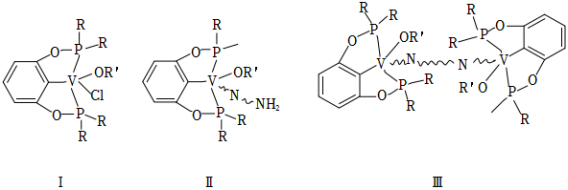
( 代表单键、双键或三键)
代表单键、双键或三键)
回答问题:
(1)配合物Ⅰ中钒的配位原子有 种,它们是_____。
(2)配合物Ⅰ中, 代表芳基, 空间结构呈角形,原因是__________。
(3)配合物Ⅱ中,第一电离能最大的配位原子是_____。
(4)配合物Ⅱ和Ⅲ中,钒的化合价分别为 和 ,配合物Ⅱ、Ⅲ和 三者中,两个氮原子间键长最长的是_____。
(5)近年来,研究人员发现含钒的锑化物 在超导方面表现出潜在的应用前景。 晶胞如图1所示,晶体中包含由 和 组成的二维平面(见图2)。
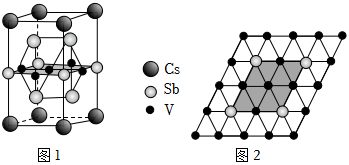
①晶胞中有 个面的面心由钒原子占据,这些钒原子各自周围紧邻的锑原子数为_____。锑和磷同族,锑原子基态的价层电子排布式为_____。
②晶体中少部分钒原子被其它元素(包括 )原子取代,可得到改性材料。下列有关替代原子说法正确的是_____。
| A. |
有 或 价态形式 |
| B. |
均属于第四周期元素 |
| C. |
均属于过渡元素 |
| D. |
替代原子与原离子的离子半径相近 |
局部麻醉药福莫卡因的一种合成路线如图:
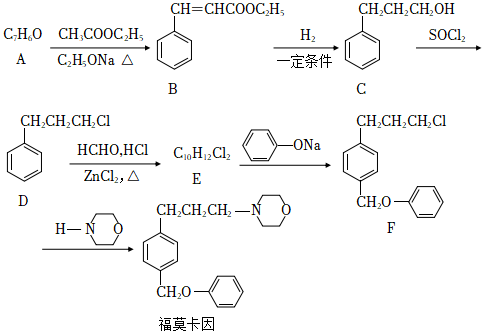
回答问题:
(1)A的结构简式:_____,其化学名称_____。
(2)B中所有官能团名称:__________。
(3)B存在顺反异构现象,较稳定异构体的构型为_____式(填“顺”或“反”)。
(4)B→C的反应类型为_____。
(5)与E互为同分异构体之——X,满足条件①含有苯环②核磁共振氢谱只有1组吸收峰,则X的简式为:_____(任写一种)。
(6)E→F的反应方程式为__________。
(7)结合上图合成路线的相关信息。以苯甲醛和一两个碳的有机物为原料,设计__________。
[化学--选修5:有机化学基础]
化合物G是治疗高血压的药物"比索洛尔"的中间体,一种合成G的路线如下:
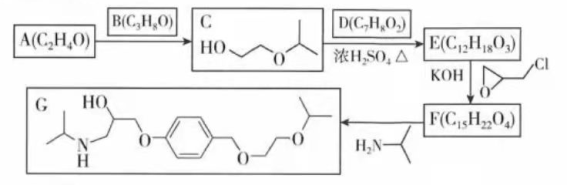
已知以下信息:
①A的核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰,峰面积比为6∶1∶1。
②D的苯环上仅有两种不同化学环境的氢; 可与 或 反应。
回答下列问题:
(1)A的结构简式为____________。
(2)B的化学名称为____________。
(3)C与D反应生成E的化学方程式为____________。
(4)由E生成F的反应类型为____________。
(5)G的分子式为____________。
(6)L是D的同分异构体,可与FeCl 3溶液发生显色反应, 的L可与 的 反应,L共有______种;其中核磁共振氢谱为四组峰,峰面积比为3∶2∶2∶1的结构简式为___________、____________。
[化学--选修3:物质结构与性质]
我国科学家最近成功合成了世界上首个五氮阴离子盐 (用R代表)。回答下列问题:
(1)氮原子价层电子的轨道表达式(电子排布图)为_____________。
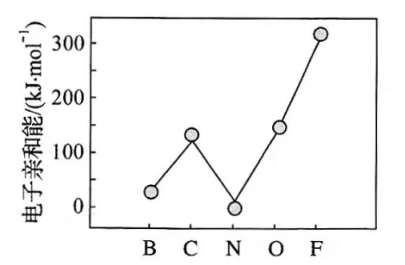
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能( E 1)。第二周期部分元素的 E 1变化趋势如下图所示,其中除氮元素外,其他元素的 E 1自左而右依次增大的原因是___________;氮元素的 E 1呈现异常的原因是__________。
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如下图所示。
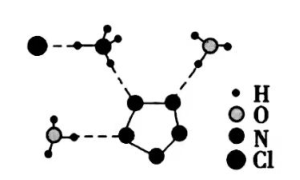
①从结构角度分析,R中两种阳离子的相同之处为_________,不同之处为__________。(填标号)
A.中心原子的杂化轨道类型B.中心原子的价层电子对数
C.立体结构D.共价键类型
②R中阴离子 中的σ键总数为________个。分子中的大π键可用符号 表示,其中 m代表参与形成大π键的原子数, n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则 中的大π键应表示为____________。
③图(b)中虚线代表氢键,其表示式为( )N−H…Cl、____________、____________。
(4)R的晶体密度为 ,其立方晶胞参数为 anm,晶胞中含有 y个[ ]单元,该单元的相对质量为 M,则 y的计算表达式为______________。
[化学--选修3:物质结构与性质]
研究发现,在 低压合成甲醇反应 中, 氧化物负载的 氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1) 基态原子核外电子排布式为________。元素 与O中,第一电离能较大的是________,基态原子核外未成对电子数较多的是________。
(2) 和 分子中 原子的杂化形式分别为________和________。
(3)在 低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为________,原因是________。
(4)硝酸锰是制备上述反应催化剂的原料, 中的化学键除了 键外,还存在________。
(5) 具有 型结构(如图),其中阴离子采用面心立方最密堆积方式, 射线衍射实验测得 的晶胞参数为 ,则 为________ 。 也属于 型结构,晶胞参数为 ,则 为________ 。

砷(As)是第四周期VA族元素,可以形成 、 、 、 等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图__________。
(2)工业上常将含砷废渣(主要成分为 )制成浆状,通入 氧化,生成 和单质硫。写出发生反应的化学方程式__________。该反应需要在加压下进行,原因是__________。
(3)已知:
则反应 的 __________。
(4)298K时,将 、 和 溶液混合,发生反应: 。溶液中 与反应时间(t)的关系如图所示。
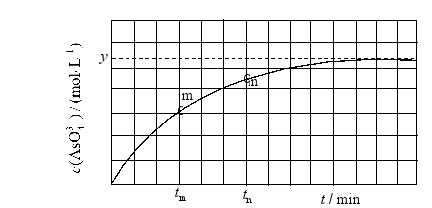
①下列可判断反应达到平衡的是__________(填标号)。
a.溶液的pH不再变化
b.
c. 不再变化
d.
② 时, __________ (填"大于"、"小于"或"等于")。
③ 时 __________ 时 (填"大于"、"小于"或"等于"),理由是__________。
④若平衡时溶液的 ,则该反应的平衡常数K为__________。
【选修五:有机化学基础】氧化白藜芦醇W具有抗病毒等作用。下面是利用Heck反应合成W的一种方法:

回答下列问题:
(1)A的化学名称为________。
(2) 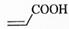 中的官能团名称是________。
中的官能团名称是________。
(3)反应③的类型为________,W的分子式为________。
(4)不同条件对反应④产率的影响见下表:
| 实验 |
碱 |
溶剂 |
催化剂 |
产率/% |
| ① |
KOH |
DMF |
|
22.3 |
| ② |
|
DMF |
|
10.5 |
| ③ |
|
DMF |
|
12.4 |
| ④ |
六氢吡啶 |
DMF |
|
31.2 |
| ⑤ |
六氢吡啶 |
DMA |
|
38.6 |
| ⑥ |
六氢吡啶 |
NMP |
|
24.5 |
上述实验探究了________和________对反应产率的影响。此外,还可以进一步探究________等对反应产率的影响。
(5)X为D的同分异构体,写出满足如下条件的X的结构简式________。
①含有苯环;②有三种不同化学环境的氢,个数比为6∶2∶1;③ 的X与足量金属Na反应可生成 。
(6)利用Heck反应,由苯和溴乙烷为原料制备 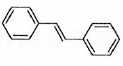 ,写出合成路线________。(无机试剂任选)
,写出合成路线________。(无机试剂任选)
【选修三:物质结构与性质】磷酸亚铁锂(
)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用
、
、
和苯胺等作为原料制备。回答下列问题:
(1)在周期表中,与Li的化学性质最相似的邻族元素是________,该元素基态原子核外M层电子的自旋状态________(填"相同"或"相反")。
(2) 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的 的结构式为________,其中Fe的配位数为________。
(3)苯胺  )的晶体类型是________。苯胺与甲苯(
)的晶体类型是________。苯胺与甲苯(  )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是________。
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是________。
(4) 中,电负性最高的元素是________;P的________杂化轨道与O的2p轨道形成________键。
(5) 和 属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:
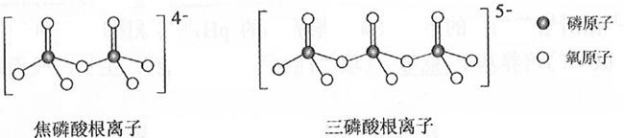
这类磷酸根离子的化学式可用通式表示为________(用 n代表P原子数)。
【选修五:有机化学基础】
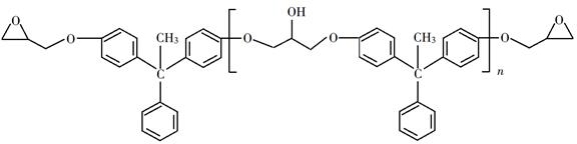
环氧树脂因其具有良好的机械性能、绝缘性能以及与各种材料的粘结性能,已广泛应用于涂料和胶黏剂等领域。下面是制备一种新型环氧树脂G的合成路线:

已知以下信息:

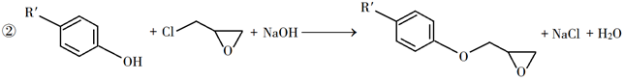
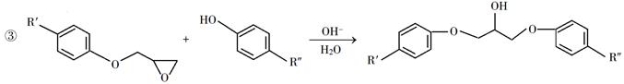
回答下列问题:
(1)A是一种烯烃,化学名称为________,C中官能团的名称为________、________。
(2)由B生成C的反应类型为________。
(3)由C生成D的反应方程式为________。
(4)E的结构简式为________。
(5)E的二氯代物有多种同分异构体,请写出其中能同时满足以下条件的芳香化合物的结构简式________、________。
①能发生银镜反应;②核磁共振氢谱有三组峰,且峰面积比为3∶2∶1。
(6)假设化合物D、F和NaOH恰好完全反应生成1 mol单一聚合度的G,若生成的NaCl和H 2O的总质量为765g,则G的 n值理论上应等于________。
【选修三:物质结构与性质】
近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe−Sm−As−F−O组成的化合物。回答下列问题:
(1)元素As与N同族。预测As的氢化物分子的立体结构为________,其沸点比NH 3的________(填"高"或"低"),其判断理由是________。
(2)Fe成为阳离子时首先失去________轨道电子,Sm的价层电子排布式为4f 66s 2 , Sm 3+的价层电子排布式为________。
(3)比较离子半径:F −________O 2−(填"大于"等于"或"小于")。
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。
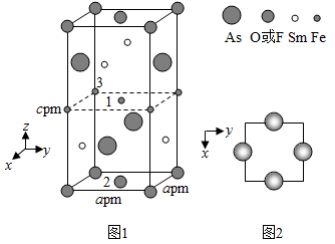
图中F −和O 2−共同占据晶胞的上下底面位置,若两者的比例依次用 x和1− x代表,则该化合物的化学式表示为________,通过测定密度 ρ和晶胞参数,可以计算该物质的 x值,完成它们关系表达式: ρ=________g·cm −3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为( , , ),则原子2和3的坐标分别为________、________。
近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:
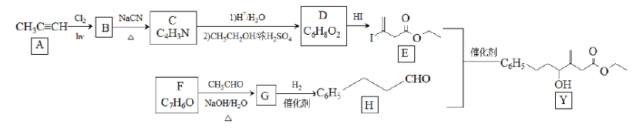
已知: 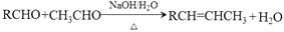
回答下列问题:
(1)A的化学名称是________。
(2)B为单氯代烃,由B生成C的化学方程式为________。
(3)由A生成B、G生成H的反应类型分别是________、________。
(4)D的结构简式为________。
(5)Y中含氧官能团的名称为________。
(6)E与F在Cr-Ni催化下也可以发生偶联反应,产物的结构简式为________。
(7)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出3种符合上述条件的X的结构简式________。
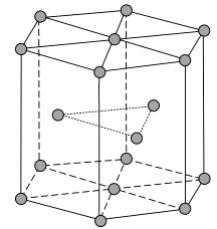
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能 ________ (填"大于"或"小于")。原因是________。
(3) 具有较高的熔点(872 ℃),其化学键类型是________; 不溶于有机溶剂而 、 、 能够溶于乙醇、乙醚等有机溶剂,原因是________。
(4)《中华本草》等中医典籍中,记载了炉甘石( )入药,可用于治疗皮肤炎症或表面创伤。 中,阴离子空间构型为________,C原子的杂化形式为________。 (5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为________。六棱柱底边边长为 acm,高为 ccm,阿伏加德罗常数的值为 , Zn的密度为________ (列出计算式)。