一种重要的有机化工原料有机物X,下面是以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。Y是一种功能高分子材料。
已知:(1)X为芳香烃,其相对分子质量为92
(2)烷基苯在高锰酸钾的作用下,侧链被氧化成羧基:
(3) (苯胺,易被氧化)
(苯胺,易被氧化)
请根据本题所给信息与所学知识回答下列问题:
(1)X的分子式为______________。
(2) 中官能团的名称为_________________;
中官能团的名称为_________________;
(3)反应③的反应类型是___________;已知A为一氯代物,则E的结构简式是____________;(4)反应④的化学方程式为__________________;
(5)阿司匹林有多种同分异构体,满足下列条件的同分异构体有________种:
①含有苯环;②既不能发生水解反应,也不能发生银镜反应;③1mol该有机物能与2molNaHCO3完全反应。
(6)请写出以A为原料制备 的合成路线流程图 (无机试剂任用)。
的合成路线流程图 (无机试剂任用)。
合成路线流程图示例如下:
无色气体A在一种黄绿色气体B中可以安静的燃烧,发出苍白色火焰,反应生成气体C。B与金属D反应可生成白色固体E,D在空气中燃烧生成浅黄色固体F,F与CO2反应可得到气体G,D与水反应可生成A, A在G中燃烧生成水。推断出各种物质后,回答下列问题:
(1)写出下列物质的化学式:B 、C 、E 。
(2)写出下列化学方程式
a.由D生成F:________________________
b.F与CO2反应:________________________
c.D与水反应:________________________
苯乙烯可以通过下列方法合成:

(1)A B的反应的反应类型是 ;该反应还会生成另一种有机物,其结构简式为 。
B的反应的反应类型是 ;该反应还会生成另一种有机物,其结构简式为 。
(2)C中含氧官能团的名称是 。
(3)检验产物D中溶有C的实验方法是 ;
(4)B有多种同分异构体。E是B的芳香类同分异构体,结构上满足下列条件。则E的结构简式为 。
A.能发生银镜反应 B.且苯环上的一氯代物只有2种
(5)对羧基聚苯乙烯( )是合成功能高分子材料的重要中间体。
)是合成功能高分子材料的重要中间体。
已知:①NaBH4为选择性还原剂,不能还原羧酸
②苯甲酸发生苯环取代时,生成间位产物。
试写出以甲苯等为主要原料,合成对羧基聚苯乙烯的流程图(无机试剂任选)。合成路线流程图示例如下:
(有机基础)
A、B、C、D、E、F和G都是有机化合物,它们的关系如下图所示:
(1)化合物C的分子式是C7H8O,C遇到FeCl3溶液显示紫色,C与溴水反应生成的一溴代物只有两种,则C的结构简式为 ______________________;
(2)D为一直链化合物,其相对分子质量比化合物C的小20,它能跟NaHCO3反应放出CO2,则D分子式为 _________________,D具有的官能团是 __________________;
(3)反应①的化学方程式是 ______________________;
(4)芳香化合物B是与A具有相同官能团的A的同分异构体,通过反应②化合物B能生成E和F,F可能的结构简式是________________________________;
(5)E可能的结构简式是_______________________________。
(14)已知A为淡黄色固体,T、R 为两种常见的用途广泛的金属单质,D具有磁性的黑色晶体, C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体。

(1)写出下列物质的化学式:D:_____________ R: _________.写出A的电子式 _______
(2)按要求写出下列反应方程式_____________________________
H在潮湿空气中变为M的化学方程式 ____________________________
B与R反应的化学方程式 ________________________
D与盐酸反应的离子方程式 _______________________
(3)向沸水中加入W饱和溶液,可制得一种红褐色透明液,该反应的离子方程式______________________
邻羟基桂皮酸是合成香精的重要原料,下为合成邻羟基桂皮酸的路线之一
 已知:
已知:
试回答下列问题:
(1)化合物II的结构简式为:________________________
(2)化合物II→化合物III的有机反应类型________________
(3)化合物III在银氨溶液中发生反应化学方程式___________________
(4)有机物X为化合物IV的同分异构体,且知有机物X有如下特点:①是苯的对位取代物,②能与NaHCO3反应放出气体,③能发生银镜反应。请写出化合物X的结构简式_____________________
(5)下列说法正确的是
| A.化合物I遇氯化铁溶液呈紫色 |
| B.化合物II能与NaHCO3溶液反应 |
| C.1mol化合物IV完全燃烧消耗9.5molO2 |
| D.1mol化合物III能与3molH2反应 |
(6)有机物R(C9H9ClO3)经过反应、再酸化也可制得化合物IV,则R在NaOH醇溶液中反应的化学方程式为。
某固体混合物可能含Al、(NH4)2SO4、MgCl2、A1Cl3、FeCl2、NaCl中的一种或几种,现对该混合物作如下实验,所得现象和有关数据如图(气体体积已换算成标况下体积):
回答下列问题:
(1)混合物中是否存在FeCl2_____________(填“是”或“否”);
(2)混合物中是否存在(NH4)2SO4_____________(填“是”或“否”),你的判断依据是________________。
(3)写出反应④的离子反应式:_________________________。
(4)请根据计算结果判断混合物中是否含有AlCl3(填“是”或“否”),你的判断依据是_________。
尼龙是目前世界上产量最大、应用范围最广、性能比较优异的一种合成纤维。以X为原料合成高分子化合物尼龙-66的流程如下:

已知部分信息如下:
I.Z的化学式为C6H10O4。
Ⅱ.X和浓溴水反应产生白色沉淀。
Ⅲ.某些醛与醛之间能发生羟醛缩合反应,例如:

请回答下列问题:
(1)X的化学名称为____ __,W的结构简式为__________,T的分子式为 _____________。
(2)反应②的条件为______________________。
(3)上述反应中属于加成反应的有 。
(4)写出反应④的化学方程式________________________。
(5)满足下列条件的S的同分异构体的结构共有________种(不考虑立体异构),①单环芳香族化合物 ②既能发生银镜反应,又能发生水解反应其中,苯环上核磁共振氢谱上有2个峰的结构简式为_________________。
下图所示各物质是由1~20号元素中部分元素组成的单质或其化合物,图中部分反应条件未列出。已知C、H是无色有刺激性气味的气体,D是一种黄绿色的气体单质,物质J可用于泳池消毒。反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法。
请回答下列问题:
(1)I中所含化学键类型_______________,
(2)G的水溶液呈酸性,用离子方程式表示其原因_______________________
(3)实验室制备气体C的化学方程式___________________________
(4)已知含7.4gI的稀溶液与200mL1mol/L的H溶液反应放出11.56kJ的热量,写出该反应的热化学方程式_________________________________
(5)物质A由三种元素组成,1 mol A与水反应可生成1 mol B和2 mol C,A化学式为_______________。
[化学—选修5,有机化学基础]
高分子材料PET聚酯树脂和PMMA的合成路线如下:

已知:
Ⅰ.RCOOR’+ R’’18OH RCO18OR’’+R’OH(R、R’、R’’代表烃基)
RCO18OR’’+R’OH(R、R’、R’’代表烃基)
|
Ⅱ. (R、R’代表烃基)
(R、R’代表烃基)
 与足量NaOH溶液反应时,最多消耗4 mol NaOH
与足量NaOH溶液反应时,最多消耗4 mol NaOH
Ⅰ.某废水中可能含有下列离子中的若干种:Fe3+、Al3+、Fe2+、Cu2+、Cl-、CO32-、NO3-、SO42-、SiO32-。现进行如下实验:
Ⅰ.取少量溶液,加入KSCN溶液,无明显变化
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色
Ⅲ.向Ⅱ中所得溶液中加入BaCl2溶液,有白色沉淀生成
Ⅳ.向Ⅱ中所得溶液中加入过量浓氨水,仅有红褪色沉淀生成,过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成
请回答下列问题:
(1)该废水一定含有的离子是_____________;
(2)实验Ⅱ中加入盐酸生成无色气体的离子方程式是________________;
(3)过滤除去Ⅳ中的蓝色沉淀,调整溶液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1:4,其离子方程式为Al+NO3-+OH- AlO2-+NH3+N2+H2O(未配平)。若除去0.2molNO3-,消耗铝____________g。
AlO2-+NH3+N2+H2O(未配平)。若除去0.2molNO3-,消耗铝____________g。
Ⅱ.某混合液中,可能大量含有的离子如下表:
| 阳离子 |
H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 |
Cl-、Br-、OH-、CO32-、AlO2- |
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如图所示: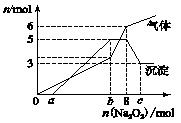
(1)该溶液中一定含有的阳离子是_____________,其对应物质的量浓度之比为____________,溶液中一定不存在的阴离子是____________________。
(2)请写出沉淀减少的离子方程式________________________。
X、Y、Z、W四种物质有如下相互转化关系(其中X、W单质,Y、Z为化合物,未列出反应条件)。
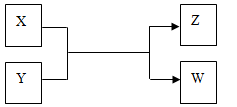
Ⅰ.若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
(1)向FeCl2溶液中加入X的水溶液,是溶液颜色变为棕黄色的微粒是 。
(2)工业上Z有多种用途,用化学方程式表示Z的一种用途 。
(3)生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到一种碘酸盐,此反应的离子方程式是 。
Ⅱ.若X是工业上用量最大的金属单质,Z是一种具有磁性的黑色晶体,则:
(1)X与Y反应的化学方程式是 。
(2)若用下列装置只进行Z + W X + Y反应(夹持装置未画出):
X + Y反应(夹持装置未画出):
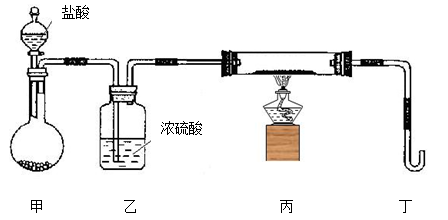
①完成此实验有多步操作,其中三步是:a.点燃酒精灯,b.滴加盐酸,c.检验气体纯度
这三步操作的先后顺序是 (填字母)。
②为保证实验成功,上述装置需要改进,方法是(用文字叙述) 。
(3)将3.48 g Z加入50 mL 4 mol/L的稀HNO3中充分反应,产生112 mL的NO(标准状况),向反应后的溶液中滴加NaOH溶液能产生沉淀。当沉淀量最多时,至少需要加入2 mol/L的NaOH溶液 mL(精确到0.1)。
某课外学习小组对日常生活中不可缺少的调味品M进行探究.已知C可在D中燃烧发出苍白色火焰.M与其他物质的转化关系如图1所示(部分产物已略去):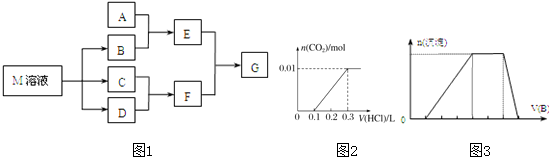
(1)写出用惰性电极电解M溶液的离子方程式_________________。写出F的电子式_____________。
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液的俗称是____________________。
(3)若A是CO2气体,A与B溶液能够反应,反应后所得的溶液再与盐酸反应,如图2所示:反应后溶液中的溶质化学式为____________________。
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是___________________。
(5)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,向G溶液中加入苯酚溶液后显紫色,则由A转化成E的离子方程式是__________________。
(6)若A是一种化肥.实验室可用A和B反应制取气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式是_________________。
(7)若A是一种溶液,只可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32-、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图3所示,由此可知,该溶液中肯定含有的离子及其浓度之比为_________________。
有A、B、C、D、E、F六种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g•L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族.均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应:均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应.
请回答下列问题:
(1)单质B的结构式:________________________。
(2)F元素周期表中的位置:_______________________。
(3)均含有F元素的乙与丁在溶液中发生反应的离子方程式___________________;均含有D元素的乙与丁在溶液中发生反应的离子方程式________________________。
(4)由A、C元素组成化合物良和A、E元素组成的化合物辛,式量均为34.其中庚的溶沸点比辛_______(填“高”或“低”),原因是_________________。
常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-,已知:
①五种盐均溶于水,水溶液均为无色。②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,一定没有的阳离子是________;所含阴离子相同的两种盐的化学式是_____________。
(2)D的化学式为__________,D溶液显碱性的原因是________________(用离子方程式表示)。
(3)A和C的溶液反应的离子方程式是_______________________;
E和氨水反应的离子方程式是________________________________。
(4)若要检验B中所含的阳离子,正确的实验方法是___________________________。