下图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。反应①常被应用于野外焊接钢轨,F是海水中含有盐的主要成分,J为D、G反应产物形成的水溶液。

请回答下列问题:
(1)B的化学式为 。
(2)反应②在工业上通常称之为 工业。
(3)写出反应③的离子方程式 。
(4)写出反应④的化学方程式 。
已知:①一定条件下,R-Cl + 2Na + Cl-R’ ® R-R’ + 2NaCl
②醛和醇可以发生氧化反应,相关物质被氧化的难易次序是:RCHO最易,R—CH2OH次之, 最难。
最难。
现有某氯代烃A,其相对分子质量为78.5;B与氯气反应生成的一氯代物有两种。有关的转化关系如下图所示(部分产物及条件均已略去):

请回答下列问题:
(1)分子式:A ;反应类型:A®C ,E®F ;
(2)结构简式:B , K为 ;
(3)反应方程式:A→E________________________________________________;
G→H________________________________________________;
(4)D的同分异构体属于羧酸的有四种,其中有2个-CH3基团的有两种。请写出这两种中的任一种结构简式: 。
现由丙二酸和乙醛等物质合成F,合成路线如下:


请回答下列问题:
(1)A的官能团的名称为 ;由逆合成分析法,推测C的结构简式 。
(2)写出反应④的化学方程式 。
(3)写出符合下列条件的D的同分异构体的结构简式 。
①与D具有完全相同的官能团
②每个碳上最多只连接一个官能团
③核磁共振氢谱有5个吸收峰
(4)已知F的质荷比最大值为384,在E的作用下合成F的化学反应方程式为: 。
已知T、X、Y、Z是中学化学常见的四种元素,其结构或性质信息如下表:
| 元素 |
结构或性质信息 |
| T |
原子的L层上s电子数等于p电子数. |
| X |
元素的原子半径是第三周期主族元素中最大的. |
| Y |
空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的. |
| Z |
单质常温、常压下是气体.原子的M层上有1个未成对的p电子. |
请根据信息回答有关问题:
(1)写出与Y2互为等电子体的分子式______________;
(2)在相同状况下,Y的简单氢化物的沸点高于Z的氢化物,其原因是______________;
(3)T、X、Y三种元素的电负性由大到小的顺序(填元素符号)是______________;
(4)元素Q的原子序数是X与Z的原子序数之和.
①该元素基态原子的最外层电子排布式为______________;
②元素Q与元素T、Y、Z分别形成平面型的[Q(TY)4]2-和四面体的[QZ4]2-,其中T与Y、Q与Z成键时中心原子采用的杂化方式分别是_________、___________;
③元素Q形成的单质的晶体结构如下图所示,该晶体形成时的原子堆积方式是__________(选填“甲”、“乙”、“丙”)。
由短周期元素组成的中学常见的含钠元素的物质A、B、C、D,存在如图转化关系(部分生成物和反应条件已略去)。

(1)若A为金属钠,则E为 ,A与水反应的离子方程式为 。
(2)若A为过氧化钠,则E为 ,A与水反应的化学方程式为 。
(3)A不论是Na还是Na2O2,依据转化关系判断物质D是 ,
(4)向10ml某浓度的B溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示两种情况(不计CO2的溶解),则曲线B表明M中的溶质为 ;原NaOH溶液的物质的量浓度为 ;由曲线A、B可知,两次实验通入的CO2的体积比为 。

Ⅰ. 已知A、B、C、D、E、F是短周期中六种非金属元素,它们的原子序数依次增大。A元素原子形成离子核外电子数为零,C、D在元素周期表中处于相邻的位置,B原子的最外层电子是内层电子数的2倍。D元素与E元素同主族;E的单质为黄色晶体,易溶于二硫化碳。
(1)请写出元素符号: A B C D E F
(2)A的单质与C的单质在一定条件下反应生成化合物X,向X的水溶液中滴加酚酞溶液,可以观察到的实验现象是 。
(3)将9g B单质在足量的D单质中燃烧,所得气体通入1L 1 mol·L-1的NaOH溶液,完全吸收后,溶液中大量存在的离子是 。
Ⅱ. 下图中A—J分别代表有关反应中的一种物质,它们均为中学化学中的常见物质。已知A—E和F—J中分别含有同一种元素。反应E→A+O2的条件未标出。
请填写下列空白:

(1) 化合物H中的阳离子是_________;D的化学式是_________________.
(2) A生成B反应的离子方程式是______________________________________.
(3) B和C反应的离子方程式是________________________________________.
(4) A和F反应的化学方程式是________________________________________.
(5) I→J反应的化学方程式是___________________,该反应过程中发生的实验现象是______________________。
A、B、C、D、E、F 6种元素,它们的核电荷数依次增大,且都小于36。其中C、E、F是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。
请回答下列问题:
(1)C、D、E四种元素的简单离子按半径由小到大的顺序为(用离子符号表示) 。
(2)元素B与D的电负性的大小关系是 ,C与E的第一电离能的大小关系是 。(填>、<、=,用元素符号表示)
(3)用轨道表示式表示D元素原子的价电子构型 。
(4)C、E最高价氧化物对应的水化物相互反应的离子方程式为 。
(5)F在元素周期表中的位置是 区,其基态原子的电子排布式为 。
(6)均为A、B、D、E四种元素组成的两种化合物可以相互反应,写出该反应的离子方程式为 。
华北地区雾霾时有发生,这与汽车尾气、工业生产排放的大量有害气体有关。下列反应中,B、C是空气质量监测的物质,其中C是红棕色气体,D是强酸(部分反应条件和产物已略去)。
A →B →C → D
(1)若A是气体单质,则A生成B的化学方程式为___________ 。
(2)若A为气态氢化物且水溶液呈碱性,则A的化学式为___________,写出A在生产生活中的一种用途_____________。
(3)D的浓溶液与铜反应的化学方程式为____________,在此反应中体现了硝酸_______性和_______性。
短周期元素形成的纯净物A、B、C、D、E,五种物质之间的转化关系如图1所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的一种相同).
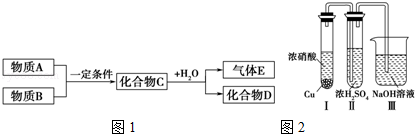
请回答下列问题:
(1)若C是离子化合物,D是一种强碱,则C的化学式 ,并任写一种C的主要用途 .
(2)若E的水溶液呈弱酸性,D是既能溶于强酸、又能溶于强碱的化合物.
①用电离方程式解释D既能溶于强酸、又能溶于强碱的原因(仅写出电离方程式即可): .
②用电荷守恒的等式表示E与NaOH溶液反应生成正盐的溶液中所有离子的浓度之间的关系: .
(3)若C是一种气体,D是一种强酸,则:
①C与水反应的化学方程式为 .
②已知常温下物质A与物质B反应生成1mol气体C的△H=﹣57kJ•mol﹣1,1mol气体C与H2O反应生成化合物D和气体E的△H=﹣46kJ•mol﹣1,写出物质A与物质B及水反应生成化合物D的热化学方程式为 .
③有人认为“浓H2SO4可以干燥气体C”.某同学为了验证该观点是否正确,用如图2所示装置进行实验.
实验过程中,在浓H2SO4中未发现有气体逸出,则得出的结论是 .
④用铂做电极电解H2SO4的溶液,其阳极的电极反应式为 .
某溶液中可能存在下列离子:NH4+、Fe2+、Cl-、SO42-、CO32-中的一种或几种,某同学为了检验它们的存在,进行了如下实验:
①取少量该溶液加入过量的Ba(NO3)2溶液,产生白色沉淀,过滤,得沉淀和滤液;
②向①的沉淀中加入足量的稀硝酸,发现沉淀不溶解;
③向①的滤液中加入硝酸银溶液,未见白色沉淀;
④再取少量原溶液加入2滴KSCN溶液,无明显现象,继续加入氯水,溶液立即变为血红色。
(1)则原溶液中一定存在的离子是______________;
(2)一定不存在的离子是______________;
(3)可能存在的离子是_________,为进一步确定该离子是否存在,该同学还应补做的实验是___________。
下列框图所示的物质转化关系中,甲是日常生活中常见的金属,乙、丙、丁是常见的气体单质。气体B与气体C相遇产生白烟,A是强碱,D的焰色反应呈紫色(部分反应物和生成物及溶剂水已略去)。
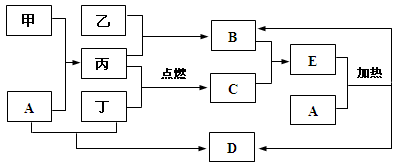
请回答下列问题:
(1)D的化学式为 。
(2)C的电子式为 。
(3)写出A溶液和甲反应的离子方程式: 。
(4)写出工业上制备B的化学方程式: 。
萜品醇可作为消毒剂、抗氧化剂、医药和溶剂。合成α-萜品醇G的路线之一如下:

已知:
请回答下列问题:
(1) 试剂Y的结构简式为________________。
(2) A催化氢化得Z(C7H12O3),写出Z在一定条件下聚合反应的化学方程式____________。
(3) B的分子式为___________;写出同时满足下列条件的B的链状同分异构体的结构简式:________________。
① 核磁共振氢谱有2个吸收峰 ② 能发生银镜反应
用CO2 和环氧化物共聚合成全降解二氧化碳基塑料,既可有效解决CO2过量排放引起的温室效应、又可除去白色污染。已知该反应为:

(-R、-R'代表烃基或氢原子)
(1)该反应为 反应。
(2) 的单体是 。
的单体是 。
通过下列途径既可以得到全降解二氧化碳基塑料还可得到用途广泛的高分子化合物PA66。
已知:

(3)A、B、C分子均为直链结构,且A、B的核磁共振氢谱都只有两个峰,峰面积之比为1:2,则
①A的结构简式是____________,名称是 。
②B是顺式结构, B→C的化学方程式是 。
③由E制备二氧化碳基塑料的化学方程式是 。
(4)D的一种同分异构体在相同条件下也能制得E,其结构简式是 。
(5)已知1 molG可与NaHCO3溶液反应产生44.8LCO2(标准状态下),则
①1 mol E与2 mol HCl反应的化学方程式是 ___________________。
② G和H在一定条件下生成PA66的化学方程式是 。
已知 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表。
| 元素 |
结构或性质信息 |
| X |
原子的L层上s电子数等于p电子数。 |
| Y |
原子核外的L层有3个未成对电子。 |
| Z |
在元素周期表的各元素中电负性仅小于氟。 |
| Q |
单质常温、常压下是气体,原子的M层上有1个未成对的p电子。 |
| R |
核电荷数是Y与Q的核电荷数之和 |
| E |
原子序数比R大3 |
请根据信息回答有关问题:
(1)元素Y的原子核外共有 种不同运动状态的电子,有 种不同能级的电子。
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号) 。
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式) 。
(4)R的最高化合价为 。R的一种配合物的化学式为RCl3·6H2O。已知0.01 molRCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.02 mol AgCl沉淀。此配合物最可能是 。
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2·H2O
C.[R(H2O)4Cl2]Cl·2H2O D.[R(H2O)3Cl3]·3H2O
(5)元素E能形成八面体构型的配合物离子[E (YH3) x Q 2]+,则中心离子为(写化学式) ,配位体为(写化学式) ,x 的值为 。
(6)Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为 。
增塑剂(DEHP)存在如下图所示的转化关系,其中A是对二甲苯(英文名称pxylene,缩写为PX)的一种同分异构体。

(1)B的苯环上存在2种不同化学环境的氢原子,则B的结构简式:_________________。
(2)D分子所含官能团:____________(填名称)。
(3)C分子有1个碳原子连接乙基和正丁基,DEHP的结构简式:__________________。
(4)F是B的一种同分异构体,具有如下特征:
a.是苯的邻位二取代物; b.遇FeCl3溶液显示特征颜色; c.能与碳酸氢钠溶液反应。
写出F与NaHCO3溶液反应的化学方程式:___________________________________。