下图是中学化学中常见有机物转化关系(部分相关物质和反应条件已略去)

已知:Ⅰ. F的相对分子质量为60,且分子中碳元素的质量分数为40% 。
Ⅱ.A可以提供生命活动所需要的能量;C、D、E、F分子含碳原子个数相同;G为高分子化合物。
回答下列问题:
(1)F中含有的官能团名称为 ,①的反应类型为 。
(2)B的结构简式为 ,G中链节为 。
(3)写出 A→C的化学方程式 。
A、B、C、D、E、F、G七种短周期元素的原子序数依次增大,其中仅有一种稀有气体元素。A和E最外层电子数相同,短周期主族元素的原子中,E原子的半径最大; B、C和F在周期表中相邻,B、C同周期,C、F同主族,F原子的质子数是C原子质子数的2倍;A和C可形成两种常见的液态化合物X和Y(相对分子质量X<Y ),D形成的分子为单原子分子.回答问题:
(1)Y的电子式为___________;
(2)液态化合物Y与稀H2SO4酸化的K2Cr2O7溶液作用可产生一种无色助燃性气体及可溶性的Cr2(SO4)3,则该反应的离子方程式为___________;
(3)用某种金属易拉罐与A、C、E组成的化合物的水溶液反应,产生的气体可充填气球,请写出该反应的离子方程式___________;
(4)P和Q两种物质都是由A、C、E、F四种元素组成的盐,其水溶液都显酸性,等物质的量的P和Q恰好完全反应.写出该反应的离子方程式___________,这两种盐均含有的化学键类型为___________;
(5)由A、B两元素形成的化合物W可作为火箭推进器中的强还原剂,已知一个W分子和一个Y分子中都含有18个电子,0.5mol液态W和足量液态Y反应,生成一种无色无味无毒的气体B2和液态X,并放出408.8KJ热量.写出该反应的热化学方程式为___________;
【化学—选修5:有机化学基础】
某抗结肠炎药物有效成分的合成路线如下(部分反应略去试剂和条件):
已知:(a)
(1)烃A的结构简式是___________;
(2)①的反应条件是___________;②的反应类型是___________;
(3)下列对抗结肠炎药物有效成分可能具有的物质推测正确的是_________;
| A.水溶性比苯酚好,密度比苯酚的大 |
| B.能发生消去反应 |
| C.能发生聚合反应 |
| D.既有酸性又有碱性 |
(4)E与足量NaOH溶液反应的化学方程式是_________;
(5)写出所有符合下列条件的E的同分异构体的结构简式_________;
a.与E具有相同的官能团
b.苯环上的一硝基取代产物有两种
(6)已知 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物 的合成路线_______________________________________(依照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
的合成路线_______________________________________(依照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下:
| 元素代号 |
X |
Y |
Z |
M |
Q |
R |
| 原子半径/nm |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
0.037 |
| 主要化合价 |
+2 |
+3 |
+6,-2 |
+2 |
-2 |
+1 |
(1)Z在周期表中的位置是_________________。
(2)X、Y、Q各自形成简单离子,其中离子半径最大的是___________(填离子符号)。
(3)周期表中有些处于对角(左上→右下)位置的元素,它们的单质及其化合物的性质存在“对角线相似”的现象,则M的氧化物与强碱溶液反应的离子方程式是___________。
(4)Q和R按原子个数比1:1组成的化合物甲,是一种“绿色”氧化剂.
①甲中所含共价键类型是___________。
②空气阴极法电解制备甲的装置如图所示.在碱性溶液中,利用空气中的氧气还原得到甲和稀碱的溶液.图中直流电源的a是_____极,阴极的电极反应式是___________。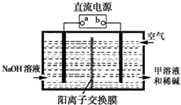
对羟基苯甲醛,俗称PHBA,是一种重要的有机化工原料。其结构为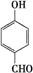 。有人提出,以对甲基苯酚为原料合成PHBA的途径如下:
。有人提出,以对甲基苯酚为原料合成PHBA的途径如下:
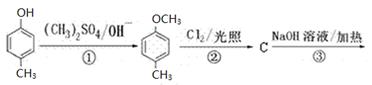
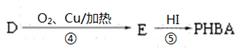

(1)PHBA的官能团的名称为___________________。
(2)下列有关PHBA的说法正确的是___________________。
| A.PHBA的分子式为C7H6O2 ; | B.PHBA是一种芳香烃; |
| C.1 mol PHBA最多能与4 molH2反应; | D.PHBA能与NaHCO3溶液反应生成CO2 ; |
(3)上述反应中属于取代反应的是____________________。
(4)反应③的化学方程式为___________________。
(5)E有多种同分异构体,符合以下所有特征的同分异构体的结构简式为 (只写一种)。
a.苯环上存在2种不同化学环境的氢原子,且个数比为1∶2;
b.遇FeCl3溶液显示特征颜色;
c.能使溴的四氯化碳溶液褪色;
A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。

(1)若X是强氧化性气体单质,则A可能是(填字母序号)
a.C b.Al c.Na d.Mg
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,X在A中燃烧产生棕黄色的烟。B的化学式为 ;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示) ;检验此C溶液中金属元素的操作方法是 ;向C的溶液中加入氢氧化钠溶液,现象是 ;请写出此过程中属于氧化还原反应的化学方程式 。
(3)若A、B、C均为含有同种金属元素的化合物,X是强酸或强碱,则B的化学式为 ,反应①的离子方程式为 或 。
下图A—H均为中学化学中最常见的物质,它们之间有如下转化关系,其中A、C均为金属单质,C与水反应生成D和最轻的气体,D、H的焰色反应均呈黄色,在通常状况下E(氢氧化物)跟NaOH或盐酸均可发生复分解反应.(反应过程中生成的水及其他产物已略去)
请回答以下问题:
(1)B是_______,H是________。(填化学式)
(2)写出E转化为G的离子方程式________。
(3)H在加热下反应生成F,写出此反应的化学方程式________。
随原子序数的递增,八种短周期元素(用字母X等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)z在元素周期表的位置是 。
(2)比较d、f简单离子的半径大小(用化学符号表示,下同) > ;
比较d、g元素的简单气态氢化物的稳定性大小 > 。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式 。
(4)已知1mol固体e的单质在足量d2气体中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式 。
(5)由上述元素组成的离子化合物 Q:eh 和 W:e2gd4,若电解含2 molQ和2 molW的混合水溶液,当阳极产生44.8L气体(标准状况下,且不考虑气体的溶解和损失)时,电路中转移电子的物质的量为 mol。
(6)上述元素可组成盐R:zx4f(gd4)2。向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1 NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:

①R溶液中,离子浓度由大到小的顺序是 。
②写出m点发生反应的离子方程式 。
③若在R溶液中改加20mL 1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为 mol。
下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物。B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。
请回答下列问题:

(1)A是 ,G是
(2)反应①~⑤中,属于氧化还原反应的是 (填序号)。
(3)反应⑤的化学方程式为 ;甲与B反应的离子方程式为 。
⑷在空气中将C溶液滴入F溶液中,观察到的现象是 。
Ⅰ有一份无色溶液,只可能有Na+、Cl-、H+、SO42-、CO32-、Cu2+、NO3-中的几种(忽略水电离产生的少量OH-)。取该溶液检测,发现溶液显强酸性。
(1)不需要进一步实验,可以判断,溶液中一定存在________,一定不存在__________。
(2)进一步测定,发现该溶液中c(H+)=0.1mol/L,取100mL该溶液,加入足量BaCl2,生成2.33g沉淀,过滤,滤液中加入足量AgNO3溶液,产生5.74g沉淀。100mL溶液中是否有Cl—______(填一定有、一定没有、可能有),100mL溶液中Na+的物质的量浓度至少为_______mol/L。
Ⅱ现有易溶于水的五种物质A、B、C、D、E,其中有一种是碱,四种是盐,溶于水后电离可以产生下表中的离子:
为鉴别它们,分别完成以下实验,其结果如下:
①A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
②B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸.
请根据上述实验结果,填空:
(1)写出下列物质的化学式:X__________,C__________,B__________
(2)完成A溶液与X气体反应的离子方程式:__________
(3)D与E的混合物ag,加入足量盐酸,反应完毕生成标准状况时的气体bL,则D在混合物中的质量分数为_____________。
(4)已知NaHCO3溶液呈碱性,B溶液与A溶液反应至恰好溶液呈中性,写出该过程的离子方程式_________
A、B、C、D、E、F六种元素为前四周期元素,原子序数依次增大。A的最高正价和最低负价的绝对值相等,B的基态原子的电子分布在3个不同的能级且各能级中电子数相等。D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子在同周期元素中未成对电子数最多。请回答下列问题:
(1)F元素在周期表中的位置 ;F元素价电子排布式为 。
(2)B、C、D、E的原子的第一电离能由小到大的顺序为 。(用元素符号回答)
(3)下列关于B2A2分子和A2D2分子的说法正确的是 。
A.分子中都含有σ键和π键
B.都是含极性键和非极性键的直线型分子
C.B2A2的沸点明显低于A2D2
D.都具有还原性
(4) 由 A、C 两种元素可以形成一种 CA5的既含离子键又含共价键的化合物,其电子式为 ;
(5) 金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。面心立方晶胞和体心立方晶胞中实际 含有的Fe原子个数之比为 。

芳香酯类化合物A、B互为同分异构体,均含C、H、O三种元素。并且各有机物间存在如下转化关系:

其中C能发生银镜反应,C最早由科学家蒸馏蚂蚁而得到;F经连续氧化可生成C;C与D是相对分子质量相同的不同类有机物。
(1)C中所含官能团的名称是 。
(2)A的分子式是 。B的结构简式是 。
(3)完全燃烧时,1 mol D与1 mol 下列 的耗氧量相同(填字母代号)。
a.C3H6O3 b.C3H8O c.C2H4 d.C2H6O2
(4)C与F反应的化学方程式是 ,反应类型是____________。
(5)水杨酸 的同分异构体很多,写出其中含苯环且属于酯类的所有同分异构体的结构简式: 。
的同分异构体很多,写出其中含苯环且属于酯类的所有同分异构体的结构简式: 。
X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大。元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-半径,Y的氧化物是形成酸雨的主要物质之一。
请回答:
(1)Q元素在周期表中的位置
(2)将这五种元素原子半径从大到小排列,排在第三的元素原子是 (填元素符号)
(3)元素的非金属性Z Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有 (填序号)
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4) X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,写出A的电子式 ;B的水溶液不呈中性的原因 (用离子方程式表示)
(5) 液态A类似X2Z能微弱电离且产生电子数相同的两种离子,则液态A的电离方程式为
(6)若使A按下列途径完全转化为F:

①F的化学式为 ;
②参加反应的A与完全转化为F时整个过程中消耗D的物质的量之比为
下图为由短周期元素形成的物质之间的转化关系,其中A、D、L为单质,其它为化合物。其中化合物I、J、K中含有两种相同的元素,G和I的反应⑤是一种重要化工生产中的主要反应之一。B常温下为液态化合物,F是中学化学中常见的气体,其固体易升华,可用于人工降雨。
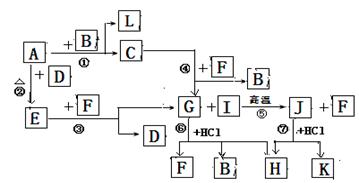
试回答下列有关问题:
(1)以上7个化学反应属于氧化还原反应的是 (用编号①→⑦填写)
(2)G、J、H中含有的相同的元素是______________;
(3)J的水溶液和F (填”能”或”不能”)发生化学反应
(4)反应⑤的化学方程式是 。
A、B、C、D、E是短周期中原子序数依次增大的主族元素,其中元素A的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。常温常压下,E单质是淡黄色固体,常在火山口附近沉积。
(1)CA与水反应放出气体的化学方程式为 。
(2)B 元素的元素符号: ;CA的电子式为 ;
D在元素周期表中的位置为 。
(3)A2E的燃烧热ΔH= -a kJ·mol-1,写出A2E燃烧反应的热化学方程式: 。
(4)甲、乙、丙分别是B、D、E三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙用量不同,反应的产物不同。回答问题:
① 向丙溶液中缓慢滴加过量的乙溶液过程中发生反应的离子方程式 , 。
② 向甲溶液中缓慢滴加等物质的量的丙溶液后,所得溶液中离子浓度由大到小的顺序为 。
(5)用D单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q。写出阳极生成R的电极反应式: ;由R生成Q的化学方程式: 。