自来水厂的水源水(原水)通常含有各种杂质,必须经过去除固体杂质和悬浮物、消毒、去除异味等一系列净化工序(即净化过程),才能达到使用标准。
(1)原水净化有下列措施:① 过滤,② 添加混凝剂,③ 加入活性炭,④ 加入消毒剂。你认为正确的顺序是;
| A.①②③④ | B.②①③④ | C.②③①④ | D.④①②③ |
(2)原水中可以加入明矾作为混凝剂,从而达到去除固体杂质和悬浮物,其原理是明矾溶于水后生成的胶体可以吸附水中的悬浮颗粒并使之沉降。写出明矾中的Al3+水解生成胶体的离子方程式_________________________________________________;
(3)目前我国不少自来水厂采用液氯消毒,液氯注入水中与水发生可逆反应,生成一种强酸和一种弱酸(次氯酸),该反应的化学方程式为______________________________。
按要求回答下列问题
(1)高温和紫外线都可以杀菌消毒,其原因是;
(2)碳酸氢钠是一种常见的疏松剂,在加热条件下产生气体,使食品变的疏松的原理是(用化学方程式表示)。
用中和滴定法测定烧碱的纯度,若烧碱中含有少量不与酸作用的可溶性杂质,试根据实验回答:
(1)准确称取4.1g烧碱样品。
(2)将样品配成250mL待测液,需要的仪器有小烧杯、玻璃棒、、胶头滴管。
(3)用量取10mL待测液于中(填仪器名称),并滴加几滴甲基橙作指示剂。
(4)用0.2010 mol·L-1标准盐酸滴定待测烧碱溶液,滴定时手旋转式滴定管的玻璃活塞,手不停地摇动锥形瓶,两眼注视锥形瓶内溶液颜色的变化,直到滴定终点,滴定终点时锥形瓶内溶液的PH约为,达到终点的具体现象是:。
(5)若两次实验滴定的数据如下表:
| 滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
10.00 |
0.50 |
20.4 |
| 第二次 |
10.00 |
4.00 |
24.1 |
据上表数据,计算待测烧碱溶液的浓度:。
(6)根据上述各数据,计算烧碱的纯度:
(7)滴定时,滴定管尖嘴部分滴定前有气泡,滴定终了无气泡,测定结果将_______(填偏高、偏低或无影响,其它操作均正确)。
下面是两位同学关于吸热反应和放热反应的对话,你同意哪位同学的说法?请陈述理由。
甲同学:凡经加热而发生的化学反应都是吸热反应。
乙同学:不一定。有些反应在启动时要加热,反应开始后不再加热就能继续进行,如燃烧反应,这类反应属于放热反应。
写出下列反应的化学方程式(每小题1分,共4分)
(1)铁与水蒸气高温下反应
(2)木炭与浓硫酸在加热条件下反应
(3)氯气与熟石灰反应制漂白粉
(4) 石灰石与石英在高温下反应制玻璃
.写出下列反应的离子方程式(每小题1分,共4分)
(1)铝与氢氧化钾浓溶液反应
(2)向偏铝酸钠溶液中通过量二氧化碳
(3)向NaHSO4溶液中加入Ba(OH)2使溶液呈中性
(4)过氧化钠与稀食盐水反应
厨房的两个调料瓶中都有些白色固体,只知它们分别是精盐(食盐)、碱面(纯碱)中的某一种,请您利用家庭现有条件,用两种方法把它们区别开来(简要写出步骤、方法、现象和结论)
某生活垃圾主要含有C、H、O、S、Cl等元素,有人认为可直接将此垃圾在空地上焚烧。你认为这一方法是否合理?请说明理由。
碳酸氢钠、碳酸氢铵是常用的疏松剂,它们在加热条件下产生气体,使食品变得疏松。请写出相关反应的化学方程式。
中学常见的某反应的化学方程式为A+B→C+D+H2O(未配平,反应条件略去)。请回答下列有关问题:
(1)若A是铁,B是稀硝酸(过量),且A可溶于C溶液中。则A与C反应的离子方程式为_________________________________________________________________。
(2)若C、D均为气体,且都能使澄清石灰水变浑浊,则上述反应的化学方程式为___________________________________________________________________________。
(3)若C是无色刺激性气味的气体,其水溶液呈弱碱性。C能发生催化氧化反应,写出该反应的化学方程式____________________________________________________。
(4)若D为氯碱工业的主要原料,C是造成温室效应的主要气体之一,则上述反应的化学方程式为_____________________________________________________。
NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得。操作步骤如下:
①用稀硫酸溶液溶解废渣,保持pH约1.5,搅拌30min,过滤。
②向滤液中滴入适量的Na2S,除去Cu2+、Zn2+,过滤。
③保持滤液在40℃左右,用6%的H2O2氧化Fe2+,再在95℃加入NaOH调节pH,除去铁和铬。
④在③的滤液中加入足量Na2CO3溶液,搅拌,得NiCO3沉淀。
⑤________________________________________________________________________。
⑥_______________________________________________________________________。
⑦蒸发、冷却结晶并从溶液中分离出晶体。
⑧用少量乙醇洗涤并凉干。
(1)步骤②除可观察到黑色沉淀外,还可嗅到臭鸡蛋气味,用离子方程式说明气体的产生:_______________________________________________。
(2)步骤③中,加6%的H2O2时,温度不能过高,其原因是:______________________
_____________________________。
(3)除铁方法有两种,一是用H2O2作氧化剂,控制pH值2~4范围内生成氢氧化铁沉淀;
另一种方法常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。下图是温度-pH值与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp= 2.64×10?39)。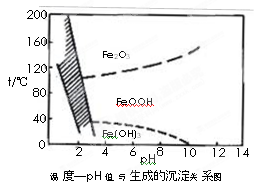
下列说法正确的是______________(选填序号)。
a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10?29
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
d.工业生产中温度常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8
(4)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单方法是:_____________
_________________________________________________________。
(5)补充上述步骤⑤和⑥【可提供的试剂有6mol/L的H2SO4溶液,蒸馏水、pH试纸】。