丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O(l);△H=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g)ΔH="-566" kJ/mol
(1)反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)的△H=
(2)C3H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:
CO (g)+H2O(g) CO2(g)+H2 (g)
CO2(g)+H2 (g)
①下列事实能说明该反应达到平衡的是
a.体系中的压强不发生变化 b.υ正(H2)=υ逆(CO)
c.混合气体的平均相对分子质量不发生变化 d.CO2的浓度不再发生变化
② T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表:
| 时间 / min |
CO |
H2O(g) |
CO2 |
H2 |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
0.100 |
0.200 |
0.100 |
0.100 |
| 4 |
0.100 |
0.200 |
0.100 |
0.100 |
| 5 |
0.116 |
0.216 |
0.084 |
C1 |
| 6 |
0.096 |
0.266 |
0.104 |
C2 |
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的。则第4~5min之间,改变的条件,第5~6min之间,改变的条件是。
已知420℃时,该化学反应的平衡常数为9。如果反应开始时,CO和H2O(g)的浓度都是0.01 mol/L,则CO在此条件下的转化率为。又知397℃时该反应的平衡常数为12,请判断该反应的△H0 (填“>”、“=”、“<”).
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2—。在电池内部O2—移向____极(填“正”或“负”);电池的负极反应式为。
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为____。
煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为和
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示: 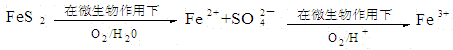
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为;第二步反应的离子方程式为。
(3)工业煤干馏得到的产品有焦炭、、等。
(4)湿式石灰石—石膏法脱硫工艺是烟气脱硫技术中最成熟的一种方法。其工艺流程是:烟气经锅炉预热器出来,进入电除尘器除掉大部分粉煤灰烟尘,再经过一个专门的热交换器,然后进入吸收塔,烟气中的SO2与含有石灰石的浆液进行气液接触,通入空气后生成石膏,经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气。
①写出湿法石灰石—石膏法脱硫所涉及的化学反应方程式:______________________。
②用石灰石浆液作SO2吸收剂而不用熟石灰吸收SO2的原因是:_________________________
③上述过程中得到的石膏,如果含氯化合物(主要来源于燃料煤)超过杂质极限值,则石膏产品性能变坏。工业上消除可溶性氯化物的方法是____________________________________。
(5)某化学兴趣小组为了测定烟气脱硫所得石膏的组成(CaSO4·xH2O)即测定x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如图所示。数据表明当固体的质量为2.72g后不再改变。①石膏的化学式为_______________。②图像中AB段对应化合物的化学式为_________________。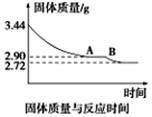
酯类是工业上重要的有机原料,具有广泛用途。
乙酸苯甲酯( )对花香和果香的香韵具有提升作用,故常用于化妆品和食品工业。乙酸苯甲酯的合成路线如下:
)对花香和果香的香韵具有提升作用,故常用于化妆品和食品工业。乙酸苯甲酯的合成路线如下:

(1)B中含氧官能团的名称是;
反应③的类型是,①的化学方程式是。
(2)下列物质中能与A的水溶液反应的是。
a.CaCO3 b.NaOH c.CuSO4d.NaCl
(3)下列物质中与甲苯互为同系物的是。
a.  b.
b. c.
c. d.
d.
(4)绿色化学的核心内容之一是“原子经济性”,即原子的理论利用率为100%。下列转化符合绿色化学要求的是_____(填序号)。
a.乙醇制取乙醛 b.甲苯制备 c.2CH3CHO+O2
c.2CH3CHO+O2 2A
2A
(5)苯甲酸苯甲酯可用作香料、食品添加剂及一些香料的溶剂,还可用作塑料、涂料的增
塑剂。工业上常用苯甲酸钠与氯甲基苯( ))在催化剂作用下反应制备。
))在催化剂作用下反应制备。
已知:
流程图示例如下:
设计以甲苯为原料(无机试剂任选)合成苯甲酸苯甲酯的流程图。
某学校开展文化周活动,活动内容有征文比赛、歌咏比赛等等,其中有一项活动是分学科的创新思维大赛。其中化学科的比赛题目之一是“假如光照条件下没有丁达尔效应……”。假如你是参加该校创新思维大赛的一名学生,请你完成你的作品。
新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害。目前降低尾气的可行方法是在汽车排气管上安装催化转化器。NO和X气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应: ①2X(g)+2NO(g) N2(g)+2CO2(g)△H=-a kJ·mol-1。
N2(g)+2CO2(g)△H=-a kJ·mol-1。
(1)上述信息中气体X的化学式为 。
(2)已知②2NO(g)+O2(g)=2NO2(g)△H=-b kJ·mol-1;X的燃烧热△H=-c kJ·mol-1。书写在消除汽车尾气中NO2的污染时,NO2与X的可逆反应的热化学反应方程式 。
(3)在一定温度下,将1.0mol NO、1.2mol气体X通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示: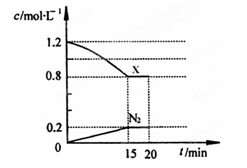
①有害气体NO的转化率为,0~15min NO的平均速率v(NO)=。
②20min时,若改变反应条件,导致X浓度增大,则改变的条件可能是(选填序号)。
| A.缩小容器体积 | B.增加CO2的量 | C.升高温度 | D.加入催化剂 |
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将移动(选填“向左”、“向右”或“不”)。
(1)已知:蒸发1 mol Br2(l)需要吸收的能量为 30 kJ,其他相关数据如下表:
| 物质 |
H2(g) |
Br2(g) |
HBr(g) |
| 1 mol分子中化学键断裂时需要吸收的能量/kJ |
436 |
200 |
369 |
H2(g)+Br2(l)=2HBr(g) ΔH=。
(2)常温下,将pH均为2的氢溴酸、乳酸(α—羟基丙酸)稀释100倍后,有一种酸的pH=4。请写出乳酸钠溶液中的水解离子方程式: 。
(3)常温下,用0.100 0 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 0 mol·L-1 HBr溶液和20.00 mL0.100 0 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如图所示:
①根据图1和图2判断,滴定HBr溶液的曲线是(填“图1”或“图2”);
②a=mL;
③c(Na+)=c(CH3COO-)的点是点;
④E点对应溶液中离子浓度由大到小的顺序为。
(13分)有机物A有如下转化关系,在A的质谱图中质荷比最大值为88,其分子中C、H、O三种元素的质量比为6:1:4且A不能使Br2的CCl4溶液褪色;1molB反应生成了2molC.
请回答下列问题:
(1)C→E的反应类型为____________
(2)若①、②、③三步反应的产率分别为93.0%、81.0%、88.0%,则由A合成H的总产率为____________
(3)A的结构简式为___________________·
(4)写出C与银氨溶液反应的离子方程式为____________________________________
(5)H分子中所有碳原子均在一条直线上,G转化为H的化学方程式为__________________
(6)X是A的一种同分异构体,且其核磁共振氢谱有3个峰,峰面积之比为1:1:2,1mol X可在HIO4加热的条件下反应,产物只有1mol Y,则X的结构简式为____________
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
N |
S |
N |
Cl- |
| 浓度/mol·L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断PM2.5的酸碱性为 ,试样的pH= 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+ O2(g) H2O(g)ΔH="-241.8" kJ·mol-1①
O2(g) H2O(g)ΔH="-241.8" kJ·mol-1①
C(s)+ O2(g) CO(g) ΔH="-110.5" kJ·mol-1②
O2(g) CO(g) ΔH="-110.5" kJ·mol-1②
写出焦炭与水蒸气反应的热化学方程式: 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:
N2(g)+O2(g) 2NO(g) ΔH>0
2NO(g) ΔH>0
若1 mol空气含0.8 mol N2和0.2 mol O2,1 300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g) 2C(s)+O2(g)
已知该反应的ΔH>0,简述该设想能否实现的依据:
。
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为 。
(18分)碱金属元素的单质及其化合物被广泛应用于生产、生活中。
②一定量的Na在足量O2中充分燃烧,参加反应的O2体积为5.6 L(标准状况),则该反应过程中转移电子的数目为_________。
(2)金属锂广泛应用于化学电源制造,锂水电池就是其中的一种产品。该电池以金属锂和 钢板为电极材料,以LiOH为电解质,加入水即可放电。
总反应为:2Li+2H2O=2LiOH+H2↑
①锂水电池放电时, 向_________极移动。
向_________极移动。
②写出该电池放电时正极的电极反应式:_________________。
③电解熔融LiCl可以制备金属Li。但LiC1熔点在873 K以上,高温下电解,金属Li产量极低。经过科学家不断研究,发现电解LiCl—KCl的熔盐混合物可以在较低温度下生成金属Li。
你认为,熔盐混合物中KCl的作用是_________________________________________。
写出电解该熔盐混合物过程中阳极的电极反应式:______________________________。
(3)最新研究表明,金属钾可作工业上天然气高温重整的催化剂,有关反应为: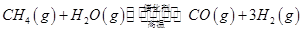 。一定温度下,向2 L容积不变的密闭容器中充入4 mol
。一定温度下,向2 L容积不变的密闭容器中充入4 mol 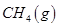 和6 mo1 H2O(g)发生反应,10 min时,反应达到平衡状态,测得CH4(g)和H2(g)的物质的量随时间变化的曲线如图所示。
和6 mo1 H2O(g)发生反应,10 min时,反应达到平衡状态,测得CH4(g)和H2(g)的物质的量随时间变化的曲线如图所示。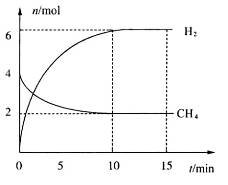
①0~10 min内用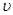 (CO)表示的化学反应速率为_________。
(CO)表示的化学反应速率为_________。
②下列叙述中,能够证明该反应已达到平衡状态的是_________(填序号)。
a.生成3 molH-H键的同时有4 molC-H键断裂
b.其他条件不变时,反应体系的压强保持不变
c.反应混合气体的质量保持不变
d.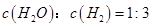
③此温度下,该反应的化学平衡常数K=_________mo12·L-2。
氯化亚铜(CuCl)是一种白色固体,微溶于水,不溶于酒精。研究该物质的应用新领域、生产新方法及生产过程中的环保新措施都具有重要意义。
(1)镁—氯化亚铜海水电池,可用于鱼雷上。该电池被海水激活时,正极导电能力增强,同时产生气泡,则正极上被还原的物质有、(填化学式)。
(2)工业上以铜作催化剂,氯代甲烷和硅粉反应合成甲基氯硅烷的过程中产生大量废渣(主要成分为硅粉、铜、碳等)。某课外小组以该废渣为原料制CuCl,流程示意图如下:
回答下列问题:
①氯代甲烷有4种,其中属于重要工业溶剂的是(写出化学式)。
②“还原”阶段,SO32-将Cu2+还原得[CuCl2]-,完成下列离子方程式。 Cu2++
Cu2++ Cl-+
Cl-+ SO32-+
SO32-+ =
= [CuCl2]-+
[CuCl2]-+ +
+
③在稀释过程中存在下列两个平衡:
ⅰ [CuCl2]- CuCl+Cl- K=2.32
CuCl+Cl- K=2.32
ⅱ CuCl(s) Cu+(aq)+Cl- Ksp=1.2×10-6
Cu+(aq)+Cl- Ksp=1.2×10-6
当[CuCl2]-完成转化时(c([CuCl2]-)≤1.0×10-5 mol·L-1),溶液中c(Cu+)≥。
④获得CuCl晶体需经过滤、洗涤、干燥。洗涤时,常用无水乙醇代替蒸馏水做洗涤剂的优点是(写一点)。
(3)工业生产CuCl过程中产生浓度为2~3 g·L-1的含铜废水,对人及环境都有较大的危害,必须进行回收利用。用萃取法富集废水中的铜,过程如下:
①实验室完成步骤ⅰ时,依次在分液漏斗中加入曝气后的废水和有机萃取剂,经振荡并后,置于铁架台的铁圈上静置片刻,分层。分离上下层液体时,应先,然后打开活塞放出下层液体,上层液体从上口倒出。
②写出步骤ⅱ的离子方程式:。
NO和NO2是常见的氮氧化物,研究它们的综合利用有重要意义。
(1)氮氧化物产生的环境问题有(填一种)。
(2)氧化—还原法消除氮氧化物的转化如下: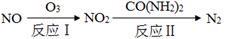
①反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是。
(3)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:
NO2(g)+SO2(g) SO3(g)+NO(g)△H=-41.8 kJ·mol-1
SO3(g)+NO(g)△H=-41.8 kJ·mol-1
①已知:2SO2(g)+O2(g) 2SO3(g)△H=-196.6 kJ·mol-1
2SO3(g)△H=-196.6 kJ·mol-1
写出NO和O2反应生成NO2的热化学方程式。
②一定温度下,向2 L恒容密闭容器中充入NO2和SO2各1 mol,5min达到平衡,此时容器中NO 和NO2的浓度之比为3∶1,则NO2的平衡转化率是。
③上述反应达平衡后,其它条件不变时,再往容器中同时充入
NO2、SO2、SO3、NO各1mol,平衡(填序号)。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
(4)某化学兴趣小组构想将NO转化为HNO3,装置如图,电极为多孔惰性材料。则负极的电极反应式是。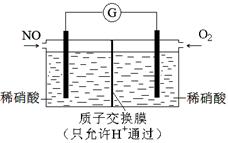
(18分)水是组成生命体的重要化学物质,有关水的反应有很多。
(1)水分子的空间构型为___________;水分子自身作用会生成阴、阳两种离子,其中阴离子的电子式是___________
(2)如图是某品牌饮用矿泉水标签的部分内容。请计算一瓶合格的这种矿泉水中硫酸根离子的物质的量不能超过___________。
(3)标况下将a L氨气溶于1L水中,得到的溶液密度为b g·cm﹣3。用化学方程式表示氨气溶于水显碱性的原因___________该溶液的物质的量浓度为___________mol·L﹣1。
(4)已知M是生活中常见的一种金属,将44.8 g M完全溶于很稀的过量硝酸,向所得溶液中加入足量固体烧碱并加热,放出6.72 L(标准状况)气体。M溶于该很稀的硝酸的离子方程式为___________________。M与水在高温条件下,生成1g气体吸热a kJ,写出该反应的热化学方程式_________________________________。
(5)味精是常用的调味品,当前味精生产主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖。
①淀粉发生水解反应的化学方程式是_________________________________
②实验室中检验淀粉水解产物应选用的试剂可以是___________ (填字母)·
| A.NaOH溶液、氨水、AgNO3溶液 | B.H2SO4溶液、氨水、AgNO3溶液 |
| C.NaOH溶液、CuSO4溶液 | D.H2SO4溶液、CuSO4溶液 |
【化学------选修物质结构与性质】
五种短周期元素甲、乙、丙、丁、戊的原子序数依次增大,甲和丙同族,乙离子和丙离子具有相同的电子层结构。甲和乙、丁、戊均能形成共价型化合物。甲和乙形成的化合物在水中呈碱性,单质丁在单质戊中可燃烧产生白色烟雾。回答下列问题:
(1)五种元素中,原子半径最大的是,非金属性最强的是;(填元素符号)
(2)由甲和乙、丁、戊所形成的共价型化合物中,热稳定性最差的是;(用化学式表示)
(3)甲和乙形成的化合物的中心原子的杂化类型为;甲和乙形成的化合物可与甲和戊形成的化合物反应,其产物中存在的化学键类型为;
(4)除乙外,上述元素的电负性从大到小依次为;(填元素符号)
(5)单质戊与水反应的离子方程式为
(6) 一定条件下1.86g单质丁与2.912L单质戊(标准状况)反应, 则产物为,(用化学式表示)其物质的量之比为。
【化学——选修化学与技术】
明矾石经处理后得到明矾[ KAl(SO4)2·12H2O]。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4 +2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是;
(2)从水浸后的滤液中得到K2SO4晶体的方法是;
(3)A12O3在一定条件下可制得AIN,其晶体结构如图所示,该晶体中Al的配位数是;
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新
型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程
式是;
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g) +O2(g) 2SO3(g)△H1= 一197 kJ/mol;
2SO3(g)△H1= 一197 kJ/mol;
2H2O (g)=2H2O(1)△H2=一44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545 kJ/mol。
则SO3 (g)与H2O(l)反应的热化学方程式是;
(6)焙烧948吨明矾(M=474 g/mol ),若SO2的利用率为96%,可生产质量分数为98%的硫
酸吨。
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:____________________________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是__________________________。
(3)吸收液吸收SO2的过程中,pH随n(SO )∶n(HSO
)∶n(HSO )变化关系如下表所示:
)变化关系如下表所示:
n(SO )∶n(HSO )∶n(HSO ) ) |
91∶9 |
1∶1 |
9∶91 |
| pH |
8.2 |
7.2 |
6.2 |
①由上表判断,NaHSO3溶液显________性,用化学平衡原理解释__________________。
②当吸收液呈中性时,下列溶液中离子浓度关系正确的是(选填字母)________。
a. c(Na+)=2c(SO )+c(HSO
)+c(HSO )
)
b. c(Na+)>c(HSO )>c(SO
)>c(SO )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
c. c(Na+)+c(H+)=c(SO )+c(HSO
)+c(HSO )+c(OH-)
)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
① HSO 在阳极放电的电极反应式是。
在阳极放电的电极反应式是。
② 当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理_______________。