由A、B、C、D四种金属按下表中装置进行实验。
| 装置 |
 |
 |
 |
| 现象 |
二价金属A不断溶解 |
C的质量增加 |
A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是___________________________________________ __。
__。
(2)装置乙中正极的电极反应式是_____________________________________________。
(3)装置丙中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)四种金属活泼性由强到弱的顺序是_________________________________________。
下图装置Ⅰ是实验室制乙酸乙酯的常用装置:

(装置1大试管口是否要加橡胶塞)
实验中所用的某些试剂及产物的相关数据如下:
| 物 质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
||
| 乙 醇 |
-114 |
78 |
0.789 |
||
| 乙 酸 |
16.6 |
117.9 |
1.05 |
||
| 乙酸乙酯 |
-83.6 |
77.5 |
0.900 |
||
| 98%H2SO4 |
10 |
338 |
1.84 |
回答下列问题:
(1)如果用CH3CO18OH与CH3CH2OH反应,写出该反应的化学方程式(在反应物和生成物中标出18O的位置) ,浓H2SO4的作用是 。
(2)要 从装置Ⅰ中右侧小试管中分离出乙酸乙酯,应进行的操作是:撤出小试管,将混合液倒入 (填仪器名称),用力振
从装置Ⅰ中右侧小试管中分离出乙酸乙酯,应进行的操作是:撤出小试管,将混合液倒入 (填仪器名称),用力振 荡,静置, (填现象),然后将产物从_____口(填“上”或“下”)倒出。
荡,静置, (填现象),然后将产物从_____口(填“上”或“下”)倒出。
(3)采用装置Ⅱ可提高乙酸乙酯的产率,结合表格中的数据,说明该装置可提高乙酸乙酯产率的原因: 。
实验室制取乙酸乙酯的主要步 骤如下:
骤如下:
①在甲试管(如图)中加入2mL浓硫酸、3mL乙醇和2mL乙酸的混合溶液.
②按右图连接好装置(装置气密性良好)并加入混合液,用小火均匀地加热3~5min。
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。④分离出乙酸乙酯层、洗涤、干燥。
(1)配制该混合溶液的主要操作步骤为:__ _____________________________________;反应中浓硫酸的作
_____________________________________;反应中浓硫酸的作 用是___________________写出制取乙酸乙酯的化学方程式:___________________________________;
用是___________________写出制取乙酸乙酯的化学方程式:___________________________________;
(2)上述实验中饱和碳酸钠溶液的作用是(填字母):_______________。
A.中和乙酸和乙醇。
B.中和乙酸并吸收部分乙醇。
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出。
(3)欲将乙试管中的物质分离开以得到乙酸乙酯,必须使用的仪器有 __________;分离时,乙酸乙酯应该从仪器 ________ (填:“下口放” 或“上口倒 ”)出。
”)出。
(11分)某同学用下图所示装置制取乙烯,请回答: 
(1)在装置①~③中,有明显错误的一个装置是_____(填序号),改进方法是
。
(2)实验室制取乙烯的化学方程式为 ,反应类型为 。
(3)配制乙醇和浓硫酸混合液的方法是 。
(4)若装置②中所盛试剂为氢氧化钠溶液,则其作为 。
(5)若装置③中的试剂为溴的四氯化碳溶液,观察到的现象是 。
(6)实验前往往在烧瓶中加入一些碎瓷片,目的是_________________________。
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH、Cl-、CO、SO,现取两份100 mL溶液进行如下实验:
①第一份加过量NaOH溶液加热后,只收集到气体0.02 mol,无沉淀生成,同时得到溶液甲。 ②在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02 g。
②在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02 g。
③第二份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65 g。
根据上述实验回答:
(1)一定不存在的离子是__________________,不能确定是否存在的离子是__________。
(2)试确定溶液中肯定存在的离子及其浓度(可不填满):
离子符号________,浓度______________________________________________;
离子符号________,浓度______________________________________________;
离子符号________,浓度______________________________________________。
(3)试确定K+是否存在________(填“是”或“否”),判断的理由是_______________。
(12分)在烧杯里加入20 mL 0.1 mol/L的Ba(OH)2溶液,再滴几滴酚酞试液,然后用滴定管向烧杯中滴加等物质的量浓度的NaHSO4溶液。实验装置如下图(夹持仪器已去掉):
实验现象如下:
①灯泡逐渐变暗;
②烧杯中有白色沉淀生成,溶液红色变浅甚至消失。
请依据实验现象回答下列问题:
(1)灯泡变暗的原因是__________________________________________________。
(2)有白色沉淀生成,说明______________________________________________,
红色变浅说明________________________________________________________。
(3)当Ba2+恰好完全沉 淀时,消耗NaHSO4溶液的体积为______ mL,溶液呈______色,离子反应方程式为_________
淀时,消耗NaHSO4溶液的体积为______ mL,溶液呈______色,离子反应方程式为_________ ___________________________________________________。
___________________________________________________。
(4)若向(3)得到的 溶液中,继续滴加NaHSO4溶液到恰好变为无色,此阶段的离子反应方程式为___________________________________________________________________。
溶液中,继续滴加NaHSO4溶液到恰好变为无色,此阶段的离子反应方程式为___________________________________________________________________。
某学生往一支试管中按一定的顺序分别加入下列几种物质(一种物质只加一次):
| A.KI溶液 | B.淀粉溶液 | C.NaOH溶液 | D.稀H2SO4E.氯水 |
发现溶液颜色按如下顺序变化:①无色―→②棕黄色―→③蓝色―→④无色―→⑤蓝 色。依据溶液颜色的变化,回答下列问题:
色。依据溶液颜色的变化,回答下列问题:
(1)加入以上药品的顺序是(写序号)_______________________________________。
(2)①―→②反应的化学方程式为_________________________________________。
(3)溶液由棕黄色变为蓝色的原因是_______________________________________。
(4)③―→④反应的化学方程式为__________________________________________。
.分别取1 mol葡萄糖进行下列实验:
(1)银镜反应时,需银氨溶液________mol, 反应后葡萄糖变为________,其结构简式为________________。
(2)与醋酸反应生成酯,从理论上讲完全酯化需________g醋酸。
(3)若使之全部转化为CO2和H2O,所需氧气的体积在标准状况下为_______L,反应的化学方程式为____________________________________________________________________
(4)与新制的Cu(OH)2反应的现象是_______________________________________。
.为除去粗盐中的Ca2+、Mg2+、Fe3+、SO以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
称取粗盐溶解①BaCl2②NaOH③Na2CO3④过滤⑤滤液适量盐酸⑥蒸发、结晶、烘干⑦精盐
(1)判断BaCl2已过量的方法是_____________________________________。
(2)第④步中,相关的离子方程式是___ ___; 。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是 。
(4)为检验精盐纯度,需配制150 mL 0.2 mol·L-1NaCl(精盐)溶液,右图是该同学转移溶液的示意图,图中的错误是_____ ___。
(10分) 铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
⑴试剂1是 。
⑵加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是 。
⑶在实验中发现放置一段时间,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:
| 编号 |
猜 想 |
| 甲 |
溶液中的+3价Fe又被还原为+2价Fe |
| 乙 |
溶液中的 被过量的氯水氧化 被过量的氯水氧化 |
| 丙 |
新制的氯水具有漂白性,将该溶液漂白 |
基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确。写出有关的实验操作、预期现象和结论。(不一定填满,也可以补充)
| 编号 |
实验操作 |
预期现象和结论 |
| |
|
|
⑷另一同学为了检测“速力菲”药片中铁的含量,设计并进行了如下实验:
①取样、碾碎,并称取2.0g,加入过量盐酸,搅拌使其完全溶解;
②向所得溶液中先加入足量H2O2溶液,再加入足量氨水,充分反应后过滤并洗涤沉淀;
③将所得固体灼烧至恒重,得0.8g红棕色固体。
④计算:“速力菲”药片中铁的质量分数为 。
(14分)为测定某有机化合物A的结构,进行如下实验。
【分子式的确定】
⑴将有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2,消耗氧气6.72L(标准状况下)。则该物质的实验式是 ;
⑵质谱仪测定有机物A的相对分子质量为46,则该物质的分子式是 ;
⑶预测A的可能结构并写出结构简式 。
【结构式的确定】
⑷核磁共振氢原子光谱能对有机物分子中不同 位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如:甲基氯甲基醚(Cl―CH2―O―CH3)有两种氢原子(下左图)。经测定,有机物A的核磁共振氢谱图如下右图,则A的结构简式为 。
位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如:甲基氯甲基醚(Cl―CH2―O―CH3)有两种氢原子(下左图)。经测定,有机物A的核磁共振氢谱图如下右图,则A的结构简式为 。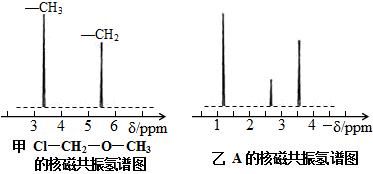
【性质实验】
⑸A在一定条件下脱水可生成B,B可合成包装塑料C,请写出B转化为C的化学反应方程式: 。
⑹体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27℃)对受伤部位进行局部冷冻麻醉。请用B选择合适的方法制备氯乙烷,要求原子利用率为100%,请写出制备反应方程式: 。
⑺A可通过粮食在一定条件下制得,由粮食制得的A在一定温度下密闭储存,因为发生一系列的化学变化而变得更醇香。请写出最后一步反应的化学方程式: 。
X、Y、Z三种短周期元素,它们的原子序数之和为16 。X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如下图所示变化:
已知一个B分子中含有的Z元素的原子个数比C分子中的少一个。
请回答下列问题:
(1)X元素在周期表中的位置是______________________。
(2)X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入__________(填物质名称);负极电极反应式为____________________。
(3)C在一定条件下反应生成A的化学方程式是
。
某化学课外小组用如图装置制取溴苯并探
究该反应的类型。先向分液漏斗中加入苯和液溴,
再将混合液滴入反应器A(A下端活塞关闭)中。
(1)写出A中反应的化学方程式:_____________
___________________________。
(2)实验结束时,打开A下端的活塞,让反应
液流入B中,充分振荡,目的是 。
(3)C中盛放CCl4的作用是 。
(4)若要证明苯和液溴发生的是取代反应,而不是加成反应,通常有两种方法,请按要求填写下表。
| |
向试管D中加入的试剂 |
能证明苯与液溴发生取代反应的现象 |
| 方法一 |
|
|
| 方法二 |
|
|
有机物A分子组成为C4H9Br,A中有一个支链,在一定条件下A可发生如下转化

|



(9分)用下图实验装置制取乙酸乙酯。回答以下问题:
(1)在A试管中加入乙醇、乙酸和浓硫酸的顺序是 _______________________________。
(2)写出A试管中发生反应的化学方程式___________________________________________
(3)B试管中所装液体应为___________,乙酸乙酯生成后,将在该溶液的______(填“上”或“下”)层,分离出该产品所需的主要仪器是_________________________________________
(4)该装置用球形干燥管代替长导管,并将干燥管的末端插入B中液面以下,在此处球形干燥管的作用有① _________________________________________________________
② _________________________________________________________________________