下图Ⅰ、II、Ⅲ是常见的气体发生装置;IV、V、VI是气体收集装置,根据要求回求答下列问题:
(1)气体发生装置的选择:若用CaCO3与盐酸反应制CO2,则可选择 ;(填序号)
若用NH4Cl和Ca(OH)2反应制NH3,则可选择 ;(填序号)
若用MnO2与浓盐酸反应制取氯气,应选用装置 ,(填序号)用离子方程式表示制取氯气的反应原理是 。
(2)收集装置的选择:若选用V为氯气收集装置,则氯气应从 口通入。用化学方法检验氯气收集满的方法是 。
(3)气体的吸收:若经试验发现,现1体积的水已吸收336体积的HCl,且得到的溶液的密度为1.08g/cm3,则所得溶液中溶质的物质的量浓度为 mol/L。
Ⅰ.实验室常用加热氯化铵和熟石灰两种固体混合物来制取氨气,其反应的化学方程式:
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O。问:
CaCl2+2NH3↑+2H2O。问:
(1)实验室制取(不包括收集)氨气的装置,可选用制取__ __(H2或O2或CO2)的装置。其理由是___ _,收集氨气可用_ ___法。
(2)若要制得干燥的氨气,可用_ ___做干燥剂。
(3)写出氨气与氧气反应的化学方程式:__ __。
(4)将氨气溶于水制成氨水,应选用下图装置中的_ ___(填序号)。
A B C
ⅠⅠ.实验室合成氨装置如右图所示,试回答
(1)装置甲的作用是:
① ,② ,③ 。
(2)从乙处导出的气体是 ,检验产物的简单化学方法
。
Ⅲ.实验室常用饱和NaNO2与NH4Cl溶液反应制取纯净氮气,反应式为:
NaNO2+NH4Cl=NaCl+N2↑+2H2O↑+Q
实验装置如下图所示,试回答:
(1)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是_______(填写编号)
a.防止NaNO2饱和溶液蒸发
b.保证实验装置不漏气
c.使NaNO2饱和溶液容易滴下
(2)加热前必须进行的一个操作步骤是___________,加热片刻后,即应移去酒精灯以防反应物冲出,其原因是 。
(3)收集N2前,必须进行的步骤是(用文字说明) ,收集N2最适宜的方法是(填写编号) 。
a.用排气法收集在集气瓶中
b.用排水法收集在集气瓶中
c.直接收集在球胆或塑料袋中
从固体混合物A出发可以发生如下框图所示的一系列变化:

(1)在实验室中常用反应①制取气体C。若要收集气体C,可选择下图装置中的 (填字母)

A B C
(2)操作②的名称是 ,在操作②中所使用的玻璃仪器的名称是 。
(3)写出下列反应的方程式:
反应①的化学方程式
反应③的化学方程式
(4)在实验室中,要获得干燥纯净的黄绿色气体F, 可以将它通过下图中的装置,其中瓶I中盛放的是 ,瓶II中盛放的是 。
 |
(5)实验中必须吸收多余的气体,以免污染空气。下图是实验室NaOH溶液吸收气体F的装置,为防止发生倒吸现象,合理的装置是 (填选项字母)

A B C
某化学课外活动小组设计了下图所示的实验装置,进行“氨的催化氧化”实验(固定装置去)。
(1)A中使用的药品是等物质的量的碳酸氧钠和碳酸氢铵,则在下列仪器中,A中未画出的仪器有 (填序号)。
①分液漏斗 ②试管 ③烧瓶 ④酒精灯 ⑤导管 ⑥橡胶塞
(2)与装置B中的药品发生反应的物质有 (填化学式),装置c中发生催化氧化反应的化学方程式为
(3)若A、B中药品足量,则装置D中可以观察到的现象自 。
(4)指导老师从安全与环保角度考虑.指出该装置有两处明显的缺陷,请你提出修改建议: 。
为了验证“铁丝可以在纯净的氧气中燃烧”及“燃烧产物有中Fe2+、Fe3+的存在”。同学们将一根火柴棒塞入一段螺旋状普通细铁丝末端固定;用镊子将铁丝夹住,然后将火柴在酒精灯上点燃,将铁丝由集气瓶口向下慢慢深入,观察现象:
(1)甲同学只发现铁丝红热一下,然后没有现象了。请你分析铁丝没有燃烧的可能原因 (填序号):
| A.氧气不纯(或没收集满) |
| B.火柴太长消耗了氧气 |
| C.铁丝表面有氧化物(或铁锈) |
| D.没有预热末端铁丝,温度没有达到铁丝的着火点 |
(2)乙同学做了一些准备工作,当铁丝在纯净氧气中燃烧时,火星四射,并有黑色固体生成。现有实验用品:细纯铁铁丝、细含碳铁丝、镁条、细铜丝、集气瓶装的几瓶纯氧、火柴、酒精灯、镊子、砂纸等。请回答:
①你对“没有火焰”的现象,能提出的问题是: ;验证方法是: 。
②为了找出铁丝在纯氧中燃烧“火星四射”的原因,其假设和对应验证方法是:
。
③如果探究发现只有含碳细铁丝在纯氧中燃烧才出现“火星四射”现象,你分析其原因是: 。
(3)丙某同学为了验证“铁在氧气的燃烧产物中有Fe2+、Fe3+的存在”,设计并进行了如下实验:
试回答下列问题:
①试剂1是 ,试剂2是 。
②加入新制氯水后溶液中颜色加深是因为(用离子方程式表示)
。
③该同学猜想血红色溶液一段时间后变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗? 。若你认为不合理,请提出你的猜想 ,并设计一个简单的实验加以验证(若你认为合理,该空不要作答) 。
某同学设计了如下装置用于制取SO2和验证SO2的性质。分流漏斗内装75%的浓硫酸,锥形瓶内装固体Na2SO3。试回答以下问题:
⑴锥形瓶内发生的反应的化学方程式为: 。
⑵实验过程中,品红试液的颜色变为: ;石蕊试液的颜色变化为: 。实验后加热烧瓶,品红试液的颜色变化为: 。
⑶溴水与SO2反应的离子方程式为: 。
⑷导管①的作用是: ;倒置漏斗的作用是 。
⑸方框内装置能否换成启普发生器? (回答“能”或“不能”)。
 某研究性小组借助
某研究性小组借助-
的仪器装置完成有关实验



【实验一】收集气体。
(1)用装置收集
气体,正确的操作上(填序号)。
 a.从①口进气,用排水法集气 b.从①口进气,用排气法集气
a.从①口进气,用排水法集气 b.从①口进气,用排气法集气
 c.从②口进气,用排水法集气 d..从②口进气,用排气法集气
c.从②口进气,用排水法集气 d..从②口进气,用排气法集气
 【实验二】为了探究镀锌薄铁板上的锌的质量分数
【实验二】为了探究镀锌薄铁板上的锌的质量分数和镀层厚度,查询得知锌易溶于碱:
↑据此,截取面积为
的双面镀锌薄铁板试样,剪碎、称得质量为
。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
 方案甲:通过测量试样与碱反应生成的氢气体积来实现探究木目标。
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究木目标。
 (2)选用
(2)选用和(填仪器标号)两个装置进行实验。
 (3)测得充分反应后生成氢气的体积为
(3)测得充分反应后生成氢气的体积为(标准状况),
=。
 (4)计算镀层厚度,还需要检索的一个物理量是。
(4)计算镀层厚度,还需要检索的一个物理量是。
 (5)若装置
(5)若装置中的恒压分液漏斗改为普通分液漏斗,测量结果将(填"偏大"、"偏小"或"无影响")。
 方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为
。
 (6)
(6)。
 方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为
方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为的质量)实现探究目标。实验同样使用仪器
。
 (7)从实验误差角度分析,方案丙方案乙(填"优于"、"劣于"或"等同于")。
(7)从实验误差角度分析,方案丙方案乙(填"优于"、"劣于"或"等同于")。
 从铝土矿(主要成分是
从铝土矿(主要成分是,含
、
、
等杂质)中提取两种工艺品的流程如下:



请回答下列问题:
 (1)流程甲加入盐酸后生成
(1)流程甲加入盐酸后生成的方程式为.
 (2)流程乙加入烧碱后生成
(2)流程乙加入烧碱后生成的离子方程式为.
 (3)验证滤液
(3)验证滤液含
,可取少量滤液并加入填试剂名称)。
 (4)滤液
(4)滤液中溶质的主要成份是(填化学式),写出该溶液的一种用途_
 (5)已知298
(5)已知298时,
的容度积常数
=5.6×10-12,取适量的滤液
,加入一定量的烧碱达到沉淀溶液平衡,测得
=13.00,则此温度下残留在溶液中的
=.
 以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略);
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略);
 (1 )从废液中提纯并结晶处
(1 )从废液中提纯并结晶处。
 (2)将
(2)将溶液与稍过量的
溶液混合,得到含
 (3)将浊液过滤,用90°C热水洗涤沉淀,干燥后得到
(3)将浊液过滤,用90°C热水洗涤沉淀,干燥后得到固体
 (4)煅烧
(4)煅烧,得到
固体
 已知:
已知:在热水中分解
 (1)中,加足量的铁屑出去废液中的
(1)中,加足量的铁屑出去废液中的,该反应的离子方程式是。
(2)中,需加一定量硫酸,运用化学平衡原理简述硫酸的作用。
 (3 )中,生成
(3 )中,生成的离子方程式是。若
浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是。
 (4)中,通过检验
(4)中,通过检验来判断沉淀是否洗涤干净。检验
操作是是。

(5)已知煅烧的化学方程式是
,现煅烧464.0
的
,得到316.8
产品,若产品中杂质只有
,则该产品中
的质量是
(摩尔质量/
;
)
 某学习小组探究浓、稀硝酸氧化性的相对强弱的,按下图装置进行试验(夹持仪器已略去)。实验表明浓硝酸能将
某学习小组探究浓、稀硝酸氧化性的相对强弱的,按下图装置进行试验(夹持仪器已略去)。实验表明浓硝酸能将氧化成
,而稀硝酸不能氧化
。由此得出的结论是浓硝酸的氧化性强于稀硝酸。

 可选药品:浓硝酸、3
可选药品:浓硝酸、3稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
 已知:氢氧化钠溶液不与
已知:氢氧化钠溶液不与反应,能与
反应

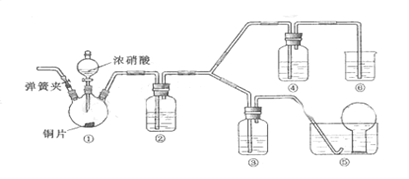
 (1)实验应避免有害气体排放到空气中,装置③、④、⑥中乘放的药品依次是
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中乘放的药品依次是
 (2)滴加浓硝酸之前的操作时检验装置的气密性,加入药品,打开弹簧夹后
(2)滴加浓硝酸之前的操作时检验装置的气密性,加入药品,打开弹簧夹后
 (3)装置①中发生反应的化学方程式是
(3)装置①中发生反应的化学方程式是
 (4)装置②的作用是,发生反应的化学方程式是
(4)装置②的作用是,发生反应的化学方程式是
 (5)该小组得出的结论一局的试验现象是
(5)该小组得出的结论一局的试验现象是
 (6)试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别涉及了一下4个试验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)
(6)试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别涉及了一下4个试验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)
 a.加热该绿色溶液,观察颜色变化
a.加热该绿色溶液,观察颜色变化
 b.加水稀释绿色溶液,观察颜色变化
b.加水稀释绿色溶液,观察颜色变化
 c.向该绿色溶液中通入氮气,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
 d.向饱和硝酸铜溶液中通入浓硝酸与铜反映产生的气体,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反映产生的气体,观察颜色变化
碱式碳酸铜可表示为:xCuCO3·yCu(OH) 2·zH2O,测定碱式碳酸铜组成的方法有多种。
 (1)现采用氢气还原法,请回答如下问题:
(1)现采用氢气还原法,请回答如下问题:
 ①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式 ;
①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式 ;
 ②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
 (a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l)
(a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l)
 |







 ③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为 g,化学式为 ;
③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为 g,化学式为 ;
 (2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。 。
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。 。
碱式碳酸铜可表示为:xCuCO3·yCu(OH) 2·zH2O,测定碱式碳酸铜组成的方法有多种。
 (1)现采用氢气还原法,请回答如下问题:
(1)现采用氢气还原法,请回答如下问题:
 ①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式 ;
①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式 ;
 ②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):

 (a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l)
(a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l)







 ③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为 g,化学式为 ;
③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为 g,化学式为 ;
 (2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。 。
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。 。

 已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。






 回答下列问题:
回答下列问题:

 (1)
(1)中加入的物质是①_.

 发生反应的化学方程式是②;
发生反应的化学方程式是②;

 (2)
(2)中加入的物质是_③,其作用是_④:

 (3)实验时在
(3)实验时在中观察到得现象是⑤,

 发生反应的化学方程式是⑥;
发生反应的化学方程式是⑥;

 (4) 实验时在
(4) 实验时在中观察到得现象是⑦_,


中收集到的物质是⑧,检验该物质的方法和现象是⑨.
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。
 Ⅰ.测定过氧化的含量
Ⅰ.测定过氧化的含量
 请填写下列空白:
请填写下列空白:
(1) 移取10.00
移取10.00 密度为
的过氧化氢溶液至250
(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00
至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2) 用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。
用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。

+
 (3)滴定时,将高锰酸钾标准溶液注入(填"酸式"或"碱式")滴定管中。滴定到达终点的现象是。
(3)滴定时,将高锰酸钾标准溶液注入(填"酸式"或"碱式")滴定管中。滴定到达终点的现象是。
 (4)重复滴定三次,平均耗用标准
(4)重复滴定三次,平均耗用标准溶液
,则原过氧化氢溶液中过氧化氢的质量分数为。
 (5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_(填"偏高"或"偏低"或"不变")。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_(填"偏高"或"偏低"或"不变")。
 Ⅱ.探究过氧化氢的性质
Ⅱ.探究过氧化氢的性质
 该化学小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
该化学小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
 请将他们的实验方法和实验现象填入下表:
请将他们的实验方法和实验现象填入下表:
| 实 验 内 容 |
实 验 方 法 |
实 验 现 象 |
| 验证氧化性 |
||
| 验证不稳定性 |
海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:


 (1)请列举海水淡化的两种方法、。
(1)请列举海水淡化的两种方法、。
 (2)将
(2)将溶液进行电解,在电解槽中可直接得到的产品有
、、、或
、。
 (3)步骤Ⅰ中已获得
(3)步骤Ⅰ中已获得,步骤Ⅱ中又将
还原为
,其目的为。
 (4)步骤Ⅱ用
(4)步骤Ⅱ用水溶液吸收
,吸收率可达95%,有关反应的离子方程式为,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是。
 (5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,了如下装置简图:


 请你参与分析讨论:
请你参与分析讨论:
 ①图中仪器
①图中仪器的名称:。
 ②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是。
 ③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:。
 ④
④中液体产生颜色为。为除去该产物中仍残留的少量
,可向其中加入
溶液,充分反应后,再进行的分离操作是。