某铜矿石中铜元素含量较低,且含有铁、镁、钙等杂质离子。某小组在实验室中用浸出-萃取法制备硫酸铜:
(1)操作I为_______。操作II用到的玻璃仪器有烧杯_______
(2)操作II、操作III的主要目的是_______、富集铜元素。
(3)小组成员利用CuSO4溶液与Na2CO3溶液混合反应,制备环保型木材防腐剂Cu2(OH)2CO3悬浊液。多次实验发现所得蓝色悬浊液颜色略有差异,查阅资料表明,可能由于条件控制不同使其中混有较多Cu(OH)2或Cu4(OH)6SO4。
已知Cu(OH)2、Cu2(OH)2CO3、Cu4((OH)6SO4均难溶于水,可溶于酸;分解温度依次为 80℃、200℃、300℃。
设计实验检验悬浊液成分,完成表中内容。
限选试剂:2mol•L-1HCl、1 mol•L-1H2SO4、0.1 mol•L-1NaOH、0.1 mol•L-1 BaCl2、蒸馏水。仪器和用品自选。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量悬浊液,过滤,充分洗涤后,取滤渣于试管中,_______________________________________________________________ |
说明悬浊液中混__________________________________________,有Cu4( OH)6SO4。 |
| 步骤2:另取少量悬浊液于试管中,____________________________ |
______________, 说明悬浊液中混有Cu( OH) 2。 |
(4)上述实验需要100mL 0.5 mol•L-1的CuSO4溶液,配制时需称取_______gCuSO4•5H2O (化学式量:250)。
某工厂废液中含有苯酚、乙酸,实验小组对该废液进行探究,设计如下方案:
己知熔点:乙酸16.6℃、苯酚43℃。沸点:乙酸118℃、苯酚182℃。
(1)写出②的反应化学方程式 。
(2)②中分离B的操作名称是 。
(3)现对物质C的性质进行实验探究,请你帮助实验小组按要求完成实验过程记录,在答题卡上填写出实验操作、预期现象和现象解释。
限选试剂:蒸馏水、稀HNO3、2moL·L—1NaOH、0.1 mol •L—1KSCN、酸性KMnO4溶 液、FeCl3溶液、饱和溴水、紫色石蕊试液。
| 实验操作 |
预期现象 |
现象解释 |
| 步骤1:取少量C放入a试管,加入少量蒸馏水,振荡。 |
|
|
| 步骤2:取少量C的稀溶液分装b、c两支试管,往b试管 |
产生白色沉淀 |
|
| 步骤3:往c试管 |
|
C与加入的试剂发生显色反应。 |
(4)称取一定量的C试样,用水溶解后全部转移至1000mL容量瓶中定容。取此溶液 25.00mL,加入浓度为0.0500 moL·L-1的溴水溶液30.00mL,放置。待反应完全后,加入过量的KI,再用0.1100 moL•L-1Na2S2O3标准溶液滴定生成的I2,耗去Na2S2O3标准溶液11.80mL。则试样中C物质的量的计算表达式为: 。 (部分反应离子方程式:I2+2S2O32—=2I—+S4O62—)
铝广泛应用于化学工业和日常生活中。工业上由铝土矿(Al2O3∙3H2O的含量约为85%,其余主要为SiO2、Fe2O3等)冶炼金属铝的流程如下。
已知拜耳法生产Al2O3∙3H2O的基本原理为:
Al2O3∙3H2O+2NaOH(aq) 2NaAlO2(aq)+4H2O,[Al2O3∙3H2O也可表示为2 Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3∙3H2O也可表示为2 Al(OH)3]
(1)操作I的名称为 ,赤泥中除含有铝硅酸盐外,还含有的主要物质有 。
(2)为了提高铝土矿的溶出速率可采取的有效措施为
(任写三点)。
(3)用化学平衡理论解释稀释溶液I有利于Al2O3∙3H2O 结晶的原因____________ 。
(4)为了析出Al2O3∙3H2O,也可向溶液I中通入过量CO2气体,写出生成Al2O3∙3H2O的离子方程式: 。
(5)为了回收赤泥附着液带走的有用成分,工业上将用热水洗涤后的洗液用作溶液I的稀释剂,请指出流程图中另一处类似的做法 。
为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究:
【查阅资料】2KNO3 2KNO2+O2↑ Fe(NO3)2
2KNO2+O2↑ Fe(NO3)2 FexOy+NO2↑+O2↑
FexOy+NO2↑+O2↑
实验一:探究Fe(NO3)2热分解固体产物中铁元素的价态。该小组甲同学将分解后的固体产物溶于足量的稀H2SO4得到相应两份溶液,进行以下探究实验。
(1)【提纯猜想】
猜想一:铁元素只显+2价;
猜想二:铁元素 ;
猜想三:铁元素既有+2价又有+3价。
【实验操作】①向一份溶液中滴入KSCN溶液;向另一份溶液中滴入酸性KMnO4稀溶液。
(2)【实验现象】实验① ;实验② 。
(3)【实验结论】猜想二成立,则Fe(NO3)2分解的化学方程式是 。
实验二:
(4)探究Fe(NO3)2热分解气体产物的性质。小组乙同学进行料如下实验,请完成实验空缺部分内容。限选试剂和用品:浓H2SO4溶液、4mol/LNaOH溶液、0.1mol/LBaCl2溶液、带火星的木条、0.1mol/L酸性KMnO4溶液、蒸馏水。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量Fe(NO3)2固体于试管中,加热分解。 |
,说明分解产生的气体中含有NO2。 |
| 步骤2:将产生的气体依次通过盛有足量 、浓硫酸的洗气瓶, 在最后一个出口检验。 |
,说明分解产生的气体中含O2。 |
实验三:KNO3中混有Fe(NO3)2,为确定其中铁元素的含量,小组丙同学进行如下实验:①取混合物样品10g,充分加热分解;②将固体产物溶解、过滤,取沉淀进行洗涤、干燥,称得其质量为3.2g。则混合物中铁元素的质量分数为 。(保留三位有效数字,相对原子质量:Fe-56 O-16)
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性。某兴趣小组用如图所示装置进行Mg与SO2反应的实验。
(1)选择制取SO2的合适试剂 (填编号)。
①浓HCl ②浓H2SO4 ③Na2SO3固体 ④CaSO3固体
(2)上述装置还可优化,优化的方法是 ,装置C中NaOH溶液的作用是 。
(3)甲同学推测Mg与SO2的反应与CO2相似,则该反应方程式为
;乙同学的推测是:2Mg+3SO2 2MgSO3+S;丙同学的推测是:3Mg+SO2
2MgSO3+S;丙同学的推测是:3Mg+SO2 2MgO+MgS,要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
2MgO+MgS,要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
已知:MgSO3和MgS都是微溶于水,能与盐酸发生复分解反应放出气体;H2S气体通入CuSO4溶液中出现黑色沉淀。
限选试剂:2mol/L HCl、2mol/L HNO3、蒸馏水、2mol/LNaOH、品红溶液、澄清石灰水、2mol/LCuSO4;仪器和用品自选。
| 序号 |
实验步骤 |
预期现象和结论 |
| ① |
取少量反应后所得固体于试管中 |
|
| ② |
向试管中的固体慢慢滴加 , 试管口塞上带导管的单孔塞,并将导管通入盛有 的试管中。 |
若试管中的 , 则丙同学推测正确。 若试管中的固体未完全溶解,且 ,则乙同学推测正确。 |
根据上述实验探究,能证明甲同学推测正确的操作和预期现象是 。
(4)上述实验需要100mL,2mol/L的HCl,配制时选用 (选填10 mL、25 mL、50 mL或100 mL)量筒量取36.5%,密度1.19g/mL的浓盐酸的体积为 mL。(保留三位有效数字)
工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下: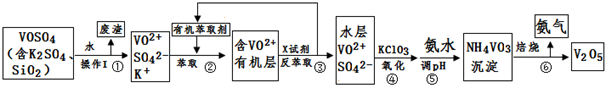
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)⑤的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH |
1.3 |
1.4 |
1.5 |
1.6 |
1.7 |
1.8 |
1.9 |
2.0 |
2.1 |
| 钒沉淀率% |
88.1 |
94.8 |
96.5 |
98.0 |
98.8 |
98.8 |
96.4 |
93.1 |
89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 ;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。〖已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39〗
(5)该工艺流程中,可以循环利用的物质有 和 。
发酵粉是一种化学膨松剂,可由小苏打、臭粉(碳酸氢铵)、明矾[KAl(SO4)2•12H2O]中的两种物质组成。某小组为探究不同品牌的发酵粉的化学成分,进行如下实验。
【提出假设】
(1)假设1:由小苏打和臭粉组成
假设2:由小苏打和明矾组成
假设3:由__________________________组成
【方案与流程】
为探究甲品牌的发酵粉的成分,某同学设计如下实验,得到如下现象:
(2)结合步骤①~③分析,气体A为________,该发酵粉的成分为__________________。
(3)若步骤①和②操作不变(现象也相同),将步骤③中足量稀盐酸改为足量氯化钡溶液,观察到有白色沉淀生成,能否确定发酵粉的成分并说明理由:________________, ____________________________________________________________________。
(4)乙品牌的发酵粉的化学组成可能为假设2情况,请设计实验验证。
实验仪器和用品任选,限选试剂:稀盐酸、0.1 mol/LNaOH溶液,写出实验步骤、预期现象和结论。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量样品溶于足量的盐酸后, 将溶液分成两份,分别装入A、B试管中。 |
|
| 步骤2:_____________________________ __________________________________ |
________________________证明有Na+,发 酵粉中有NaHCO3。 |
| 步骤3:_____________________________ ___________________________________ |
___________________________________ _______,结合步骤2中的结论,假设2成立。 |
实验室用硫酸厂烧渣(主要成分为Fe2O3及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4•7H2O),有关的工艺流程如下:
(1)将过程②中产生的气体通入下列溶液中,溶液不会褪色的是___________(填编号);
| A.品红溶液 | B.紫色石蕊溶液 |
| C.酸性KMnO4溶液 | D.溴水 |
(2)在①中已知FeS中铁元素生成Fe3+,S元素生成单质硫,FeS、O2、H2SO4反应的方程式是 ;
(3)在③中,需加入的物质是___________________________;
(4)在④中,蒸发浓缩需要的硅酸盐仪器除酒精灯外,还有_______________________;
(5)在⑥中,将溶液Z控制到70~80℃的目的是________________________________;
(6)为测量聚铁样品中铁元素的质量分数,进行下列实验(假设杂质中不含铁元素和硫元素):称取2.700g样品,将样品溶于足量的盐酸后,滴加过量的BaCl2;过滤、洗涤、干燥,称量固体的质量为3.495g。若该聚铁主要成分为[Fe(OH)(SO4)]n,求该聚铁样品中铁元素的质量分数[Mr (BaSO4) =233、Mr (Fe) =56]。(写出计算过程,结果保留4位有效数字)。
NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+ = Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况。
(1)此消毒液中NaClO可吸收空气中的CO2生成NaHCO3和HClO而变质。写出化学反应方程式 。
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过以下装置检验气体的成分可以判断消毒液是否变质。
限选试剂:98%浓硫酸、1%品红溶液、1.0 mol·L-1 KI-淀粉溶液、1.0 mol·L-1NaOH、澄清石灰水、饱和NaCl溶液
请完成下列实验方案。
| 所加试剂 |
预期现象和结论 |
| 试管A中加足量① ; 试管B中加1%品红溶液; 试管C中加② 。 |
若A中溶液变蓝色,B中溶液不退色,C中溶液变浑浊。则消毒液部分变质; ③ 则消毒液未变质; ④ 则消毒液完全变质。 |
(3)用滴定法测定消毒液中NaClO的浓度。实验步骤如下:
①量取 25.00mL消毒液放入锥形瓶中,加入过量的a mol·L-1 Na2SO3溶液b mL;
②滴定分析。将c mol·L-1的酸性KMnO4溶液装入 (填酸式或碱式)滴定管中;KMnO4和剩余的Na2SO3发生反应。当溶液由无色变成浅红色,且保持半分钟内红色不退时,停止滴定,记录数据。重复滴定实验2次,平均消耗酸性KMnO4溶液v mL;
滴定过程中涉及的反应有:NaClO + Na2SO3 = NaCl+ Na2SO4 ;
2KMnO4 + 5Na2SO3+ 3H2SO4 = K2SO4 + 2MnSO4 + 5Na2SO4 + 3H2O
③计算。消毒液中NaClO的浓度为 mol·L-1(用含a、b、c、v的代数式表示)。
医用氯化钙可用于补钙、抗过敏和消炎等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙工艺流程为: 
已知:查阅资料得知氢氧化物沉淀时的pH为:
| 氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
|
| 开始沉淀时的pH |
2.3 |
4.0 |
开始溶解:7.8 |
| 完全沉淀时的pH |
3.7 |
5.2 |
完全溶解:10.8 |
(1)CaCO3与盐酸反应的离子方程式 。
(2)除杂操作是加入氢氧化钙,调节溶液的pH为 ,目的是除去溶液中少量的Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是
。
(3)过滤时需用的玻璃仪器有 。滤渣主要成分的化学式 。
(4)酸化时加盐酸的目的为:① ,②防止Ca2+ 在蒸发时发生水解。
(5)为什么蒸发结晶要保持在160℃: 。
(6)测定晶体样品的纯度:若用一定浓度的AgNO3溶液滴定一定质量的晶体样品,所测样品中CaCl2 ·2H2O的质量分数偏高(忽略其它实验误差),可能的原因之一为 。
在实验室模拟工业生产碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体。
(1)该过程的化学方程式: 。
(2)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置是 。
A B C D
(3)得到的纯碱制品含有少量NaHCO3和NaCl,设计实验验证样品中各种组分。试剂和仪器限选用:试管、胶头滴管、过滤装置、Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、澄清石灰水、稀硫酸、稀盐酸、稀硝酸。
| 步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解。往试管中加入 振荡,观察 |
现象:溶液中产生大量白色沉淀; 结论: 。 |
| 步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入 , 振荡,观察 |
现象: ; 结论:样品中含有NaHCO3。 |
| 步骤三:将步骤二的浊液过滤,取滤液于试管C中, 振荡,观察 |
现象: ; 结论: 。 |
(4)用碘量法测量自来水中残留的Cl2的浓度:
① 在大锥形瓶中放置过量的KI,加一定量的冰醋酸,准确取水样200mL加入瓶中,迅速塞上瓶塞摇动,水样呈淡黄色,发生反应:Cl2+2I-=2Cl-+ I2。
②加少许淀粉溶液,用cmol/L Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当 ,达到滴定终点。
③重复操作3次,平均读数为V mL,则该样品中残留Cl2的浓度: mg/L(Cl的相对原子质量:35.5)
钡盐生产中排出大量的钡泥[主要含BaCO3、BaSO3、Ba(FeO2)2等],某主要生产BaCO3的化工厂利用钡泥制取Ba(NO3)2晶体及其他副产物,其部分工艺流程如下:
已知:① Fe(OH)3和Fe(OH)2完全沉淀时,溶液的pH分别为3.2和9.7
② Ba(NO3)2在热水中溶解度较大,在冷水中溶解度较小
③ KSP(BaSO4)=1.1×10-10,KSP (BaCO3)=5.1×10-9
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。用离子方程式说明提纯原理: 。
(2)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为:
。
(3)该厂结合本厂实际,选用的X为 ;
| A.BaCl2 | B.BaCO3 | C.Ba(NO3)2 | D.Ba(OH)2 |
(4)废渣2为 。
(5)操作III为 。
(6)过滤3后的母液应循环到容器 中。(填“a”、“b”或“c”)
(7)称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m克,则该Ba(NO3)2的纯度为 (相对分子质量:Ba(NO3)2为261,BaSO4为233)。
乙酰水杨酸俗称阿司匹林,是一种历史悠久的解热镇痛药。合成原理是:
虚框中为提纯原理,是为了除去该反应的副产物:水杨酸酐、乙酰水杨酸水杨酯、乙酰水杨酸酐和聚合物等。水杨酸(熔点158℃)和乙酰水杨酸(熔点135℃)微溶于冷水、可溶于热水和乙酸乙酯。生产流程是:
(1)操作I、III的名称是 ;使用热水浴加热的原因是 。
(2)可以循环利用的是 ;固体2的成份是 。
(3)为了检验产品中是否含有水杨酸,并进行精制(除去产品中的其它反应物和副产物),进行以下操作,请完成下表:
| 序号 |
操作 |
现象 |
结论 |
| 检 验 |
取几粒产品晶体投入装适量热水的试管中,振荡 |
得无色溶液 |
|
| 向试管中滴入 溶液 |
. |
产品中有水杨酸 |
|
| 重 结晶 |
将粗产品溶于适量的水中,水浴加热,趁热过滤,将滤液 ,抽滤 |
有晶体析出 |
精产品 |
(4)用中和法测定产品纯度:
取a g产品溶解于V1 mL1mol/L的NaOH溶液中,加热使乙酰水杨酸水解,再用1 mol/L的盐酸滴定过量的NaOH,当滴定终点时消耗盐酸V2 mL;计算出产品纯度为 (只需列出计算表达式,不必化简。乙酰水杨酸分子量为180)。
铁触媒(铁的氧化物)是硫酸工业的催化剂。某同学设计了以下两种方案研究铁触媒的组成。
方案一:用下列装置测定铁触媒的含铁量,确定其组成。
方案二:用下列实验方法测定铁触媒的含铁量,确定其组成。
(1)步骤④中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和 。
(2)因为通入Cl2不足量,“溶液B”中还含有 会影响测定结果。
(3)因为通入Cl2过量且加热煮沸不充分,“溶液B”中可能含有Cl2。请设计实验方案检验Cl2,完成下列实验报告。
限选试剂:0.1mol·L-1酸性KMnO4溶液、紫色石蕊试液、品红稀溶液、淀粉-KI溶液、0.1moL·L-1KSCN溶液
| 实验操作 |
实验现象与结论 |
| |
|
(4)“干燥管C”的作用是 。
(5)称取15.2g铁触媒进行上述实验。充分反应后,测得“干燥管B”增重11.0g,则该铁触媒的化学式可表示为 。
钒及化合物用途广泛。工业上常用含少量Al2O3的钒铁矿(FeO×V2O5)碱熔法提取V2O5。简要工艺流程如下:
已知:①焙烧时可发生反应:V2O5+Al2O3+2Na2CO3 2NaVO3+2NaAlO2+2CO2↑
2NaVO3+2NaAlO2+2CO2↑
②常温下物质的溶解度:NaVO3~21.2 g /100g水;HVO3~0.008 g/100g水
(1)“浸出渣B”的主要成分是 。(写化学式)
(2)生产中,不直接用H2SO4浸泡“烧渣A”获取HVO3的原因是 。
(3)“操作①”包括 、洗涤。如果不洗涤,则产品中可能含有的金属阳离子是 、 。下列装置(部分夹持仪器省去)可用在实验室进行“操作②”的是 。(填序号)
A B C D
(4)NaVO3用于原油的脱硫技术,由V2O5溶于NaOH溶液中制取,反应的离子方程式为 。
(5)V2O5还可用于将硅铁炼成钒铁。生产中加入CaO可节能减排。有关反应如下:
2V2O5(l)+ 5Si(s)+ 5CaO(s)=" 4V(s)+" 5CaSiO3(s) △H1 =" —2096.7" kJ/mol
已知:CaSiO3(s)=" CaO(s)+" SiO2(s) △H2 =" +92.5" kJ/mol
则:2V2O5(l)+ 5Si(s)=" 4V(s)+" 5SiO2(s) △H3 = 。